
【题目】下列关于反应热的表述正确的是
A. 当ΔH为“-”时,表示该反应为吸热反应
B. 已知C(s)+![]() O2(g)====CO(g)的反应热为110.5 kJ/ mol,说明碳的燃烧热为110.5 kJ / mol
O2(g)====CO(g)的反应热为110.5 kJ/ mol,说明碳的燃烧热为110.5 kJ / mol
C. 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D. 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,放出的热量:CH3COOH<HNO3
【答案】D
【解析】
试题A、放热反应的△H<0,为“一”值,吸热反应的△H>0,为“+”值,A错误;B、燃烧热的概念:在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.定义要点:可燃物完全燃烧生成稳定化合物所放出的热量为标准.而在此反应中,C(s)没有完全燃烧,故110.5kJ/mol不是C(s)的燃烧热,B错误;C、反应物所具有总能量和生成物所具有总能量的相对大小决定了反应是吸热还是放热.当反应物所具有总能量大于生成物所具有总能量时,反应放热,反之则吸热,C错误;D、依据酸碱中和反应的概念分析,强酸强碱完全反应生成1mol水放出的热量,醋酸是弱酸存在电离平衡是吸热过程,1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH<HNO3,D正确。


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下列水解的离子方程式中书写正确的是
A. S2-+ H2O = HS-+OH- B. CH3COO- + H2O![]() CH3COOH + OH-
CH3COOH + OH-
C. Al3++ H2O =Al(OH)3 D. CO32-+ 2H2O![]() H2CO3+ 2OH-
H2CO3+ 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种用途广泛的无机化工原料,一种以氧化铜矿(CuO,含有Fe2O3、Al2O3、SiO2杂质)为原料制备Cu2O的流程如图所示:

已知氨浸过程中仅发生的反应为:CuO+4NH3·H2O= [Cu(NH3)4]2++2OH-+3H2O
回答下列问题:
(1)氨浸之前需将矿物粉碎、过筛,目的是_______________________________。
(2)氨浸时的温度一般不超过30℃,主要原因是__________________。按此工艺,能否用NaOH溶液代替氨水?__________________(填“能”或“否”)。
(3)蒸馏过程中会生成一种黑色固体,则此过程中发生反应的化学方程式为____________。
(4)电解过程中阳极的电极反应式为_________________。
(5)Cu(OH)2也可与NH3·H2O反应,已知常温下:
Cu(OH)2(s)+4NH3·H2O(aq)![]() [Cu(NH3)4]2+(aq)+2OH-(aq)+4H2O(l) K1=4.4×10-7
[Cu(NH3)4]2+(aq)+2OH-(aq)+4H2O(l) K1=4.4×10-7
Cu2+(aq)+4NH3·H2O(aq)![]() [Cu(NH3)4]2+(aq)+4H2O(l) K2=2.0×1013
[Cu(NH3)4]2+(aq)+4H2O(l) K2=2.0×1013
则常温下Ksp[Cu(OH)2]=________________。
(6)为了尽量减少流程中所用原料的种类,还原过程可用气体A代替气体B,在加热条件下生成两种单质,该反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的二元弱酸,还是一种重要的还原剂。草酸及草酸盐在工农业生产及科学研究领域均有广泛应用。
(1)请设计实验证明草酸为二元酸___________________________。
(2)已知草酸氢钾(KHC2O4)溶液显酸性,请结合必要的化学用语解释KHC2O4溶液显酸性的原因 ________。
(3)利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。方法如下:抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸,再用已知浓度的酸性KMnO4溶液滴定,使草酸转化成CO2逸出,根据消耗的KMnO4溶液的体积即可测定血液样品中Ca2+的浓度。
①写出草酸与酸性KMnO4溶液反应的离子方程式______________。
②抽取血样10.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.010mol/L KMnO4溶液滴定。在向滴定管中注入KMnO4标准溶液前,滴定管需要检漏、____和___。确定反应达到终点的现象是__。
③滴定结束共消耗12.00mL KMnO4溶液。则血液样品中Ca2+离子的浓度为______mg/mL。
④下列操作可能使所测定结果偏高的是_________。
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示人体细胞内化学元素所形成的化合物(①~④表示化合物),下列相关说法错误的是( )
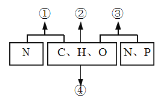
A. ①可以表示蛋白质
B. ②可以表示“生命的燃料”——葡萄糖
C. ③表示的小分子物质可能是核苷酸
D. ④是细胞膜重要的组成成分,可以表示磷脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:四甲基氢氧化铵[(CH3)4NOH ]是强碱,甲胺 (CH3NH2H2O)为弱碱。常温下,在体积均为20 mL、浓度均为0.1 mol/L的四甲基氢氧化铵溶液和甲胺溶液中,分别滴加浓度为0.1 mol/L的盐酸,溶液的导电率与盐酸体积的关系如图所示。下列说法正确的是

A. pH的相对大小: c>d
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b 点溶液:c(H+)+c(CH3NH3+) = c(OH-)
D. c 点溶液:c(Cl-)>c(CH3NH3+) >c(H+) >c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。由题干及图形可知,V1∶V2=________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为__________mol/L。若NaOH溶液用相同浓度和体积的下列溶液代替,则对中和热数值测定结果将如何影响(填“偏大”、“偏小”、“无影响”):KOH溶液______;氨水(NH3·H2O)___________。

(2)用惰性电极进行电解下列电解质溶液。
①电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为___________
②MnO2可做超级电容器材料,电解MnSO4溶液可制得MnO2,其阳极的电极反应式_________________
(3)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数Ka分别为: 7.1 10-4, 2.98 10-8。将0.1mol/L的亚硝酸稀释100倍,c(H+)将_______(填“不变”、“增大”、“减小”)。写出HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的离子方程式_______________。
(4)酸HX和碱AOH恰好完全中和时溶液的pH等于7,酸HY和碱BOH恰好完全中和时溶液的pH也等于7,酸HX和碱BOH恰好完全中和时溶液的pH小于7,请推断
①以上酸碱中必为弱电解质的是_______________
②比较两种酸HX和HY的酸性强弱 ___________>___________
(5)如图为钠硫高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS![]() Na2Sx,正极的电极反应式为_________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的__________
Na2Sx,正极的电极反应式为_________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的__________
倍。

(6)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0![]() 10-38、1.0
10-38、1.0![]() 10-11,向浓度均为0.1 mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是________。(已知lg 2=0.3)
10-11,向浓度均为0.1 mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是________。(已知lg 2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把氢氧化钙放入蒸馏水中,一定时间后达到下列溶解平衡:Ca(OH)2 (s) ![]() Ca2+(aq) + 2OH-(aq),加入下列固体物质,可使Ca(OH)2固体减少的是( )
Ca2+(aq) + 2OH-(aq),加入下列固体物质,可使Ca(OH)2固体减少的是( )
A. CaCl2 B. NaHCO3 C. NaOH D. NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com