
【题目】下图表示人体细胞内化学元素所形成的化合物(①~④表示化合物),下列相关说法错误的是( )
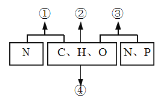
A. ①可以表示蛋白质
B. ②可以表示“生命的燃料”——葡萄糖
C. ③表示的小分子物质可能是核苷酸
D. ④是细胞膜重要的组成成分,可以表示磷脂
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】某实验小组学生按照课本实验要求,用50 mL 0.5 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量计算中和热。下列说法正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯内填满碎纸条的作用是固定小烧杯
D. 酸或碱的物质的量越大,所测中和热的数值越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法正确的是

A. 吸附层(a)上的电势比吸附层(b)上的高
B. 负极反应为H2+2e-+2OH-=2H2O
C. 该装置将酸碱中和反应的热能转化为电能
D. 电解质溶液中ClO4-由左往右迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是将化学能转化为电能的装置。分析甲、乙两原电池装置,回答下列问题:

(1)甲、乙两装置中铜电极都产生大量的无色气泡,则Cr电极是______极,Cu电极表面发生反应的电极反应式为_______;与甲装置相比,乙装置的优点是________________,原因是_________。
(2)如果将甲装置中的稀硫酸改为浓硝酸,则铜电极上无气体产生,而铬电极上产生大量的有色气体。由(1)、(2)两个实验推测金属Cr具有的两点化学性质______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁在印刷、医药、颜料、污水处理以及有机合成催化剂方面有重要的应用。工业上常以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料制备氯化铁。其生产流程如图:

已知:氢氧化物的Ksp下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 1.0×10-36 | 1.6×10-14 | 2.0×10-33 | 1.2×10-11 |
请回答下列问题:
(1)物质X最好选用下列物质中的____(选填序号),加入X的目的是_________。
A.KMnO4 B.FeCl3 C.H2O2 D.HNO3
(2)滤液Ⅰ加入NaOH溶液的目的是调节溶液的pH。已知滤液Ⅰ中c(Fe3+)为1.0mol·L-1,c(Al3+)为0.03mol·L-1,当Fe3+沉淀完全时(c(Fe3+)为1×10-5mol·L-1),Al3+是否已经开始沉淀,请通过计算说明______________。
(3)写出滤渣1加NaOH溶液发应的离子方程式_____________________。
(4)滤渣2中加过量盐酸的目的是_____________________________。
(5)FeCl3具有净水作用,但易腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
①FeCl3净水的原理是________。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)_________。
②FeCl3在溶液中分三步水解:Fe3++H2O![]() Fe(OH)2++H+ K1,Fe(OH)2++H2O
Fe(OH)2++H+ K1,Fe(OH)2++H2O![]() Fe(OH)2++H+ K2,Fe(OH)2++H2O
Fe(OH)2++H+ K2,Fe(OH)2++H2O![]() Fe(OH)3+H+ K3,以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_______。
Fe(OH)3+H+ K3,以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_______。
③通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的表述正确的是
A. 当ΔH为“-”时,表示该反应为吸热反应
B. 已知C(s)+![]() O2(g)====CO(g)的反应热为110.5 kJ/ mol,说明碳的燃烧热为110.5 kJ / mol
O2(g)====CO(g)的反应热为110.5 kJ/ mol,说明碳的燃烧热为110.5 kJ / mol
C. 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D. 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,放出的热量:CH3COOH<HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产钠和烧碱的原理如下:①电解熔融氯化钠制钠:2NaCl(熔融) ![]() 2Na+Cl2↑,②电解饱和食盐水制烧碱:2NaCl+2H2O
2Na+Cl2↑,②电解饱和食盐水制烧碱:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,下列有关说法正确的是( )
2NaOH+H2↑+Cl2↑,下列有关说法正确的是( )
A.在反应①和②中,氯化钠均既是氧化剂,又是还原剂
B.在反应①中氯气是还原产物,在反应②中氢气是还原产物
C.若标准状况下生成等体积的气体,则反应①和②中转移电子总数相等
D.若消耗等质量的氯化钠,则反应①和②中转移电子总数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某无色透明溶液中仅含有包括Na+和CH3COO-在内的四种离子。
请回答下列问题。
(1)该溶液中的溶质可能有三种情况,请分别写出各种情况的化学式:
①_____________________;②________________________;③____________________ 。
(2)25℃,若由0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合,测得混合溶液的pH=8,则c(CH3COOH)+c(H+)的精确值为___________________mol/L。
(3)若该溶液的pH=8,则c(Na+)-c(CH3COO-)的精确值为___________________mol/L。
(4)当溶液中各离子浓度大小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,则该溶液可能是____(填序号);
A.由0.1 mol/L的CH3COONa溶液与0.1 mol/L的CH3COOH溶液等体积混合而成
B.由0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合而成
C.由0.2 mol/L的CH3COONa溶液与0.1 mol/L的HCl溶液等体积混合而成
D.由0.2 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合而成
(5)常温下,将a mol/L的CH3COOH溶液与0.01 mol/L的NaOH溶液等体积混合,反应平衡后溶液中c(Na+)=c(CH3COO-),用含a的代数式表示CH3COOH的电离平衡常数Ka=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是最基本的有机化工原料之一。工业上可用二氧化碳和氢气反应来生产甲醇。
(1)已知气态甲醇的燃烧热为a kJ/mol,2H2(g)+O2(g) = 2H2O(g) ΔH= -bkJ/mol;H2O(g)=H2O(l) ΔH= -ckJ/mol。 则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=_________。
CH3OH(g)+H2O(g)的ΔH=_________。
(2)某温度下,在2 L密闭容器中,充入2.4 mol CO2和4.4 mol H2,发生合成甲醇的反应,测得甲醇的物质的量随时间的变化图像如图中的曲线I,则前4分钟ν(CO2)=__________;若在1 min时,改变某一反应条件,曲线I变为曲线II,则改变的条件为___________;该温度下反应的化学平衡常数为___________。

(3)在另一温度下发生合成甲醇的反应,如图关闭K,向A容器中充入1 mol CO2和4 mol H2,向B容器中充入1.2 mol CO2和4.8 mol H2,两容器分别发生上述反应。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为0.9a L,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为______L(不考虑温度的变化,P为可自由滑动活塞,不考虑活塞的摩擦力)。

(4)一定条件下甲醇可进一步氧化转化为甲酸。室温下,将amol/L的甲酸与bmol/L的NaOH溶液等体积混合,体系中存在c(Na+)=c(HCOO-),试用含a和b的代数式表示甲酸的电离常数为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com