
【题目】甲醇是最基本的有机化工原料之一。工业上可用二氧化碳和氢气反应来生产甲醇。
(1)已知气态甲醇的燃烧热为a kJ/mol,2H2(g)+O2(g) = 2H2O(g) ΔH= -bkJ/mol;H2O(g)=H2O(l) ΔH= -ckJ/mol。 则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=_________。
CH3OH(g)+H2O(g)的ΔH=_________。
(2)某温度下,在2 L密闭容器中,充入2.4 mol CO2和4.4 mol H2,发生合成甲醇的反应,测得甲醇的物质的量随时间的变化图像如图中的曲线I,则前4分钟ν(CO2)=__________;若在1 min时,改变某一反应条件,曲线I变为曲线II,则改变的条件为___________;该温度下反应的化学平衡常数为___________。

(3)在另一温度下发生合成甲醇的反应,如图关闭K,向A容器中充入1 mol CO2和4 mol H2,向B容器中充入1.2 mol CO2和4.8 mol H2,两容器分别发生上述反应。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为0.9a L,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为______L(不考虑温度的变化,P为可自由滑动活塞,不考虑活塞的摩擦力)。

(4)一定条件下甲醇可进一步氧化转化为甲酸。室温下,将amol/L的甲酸与bmol/L的NaOH溶液等体积混合,体系中存在c(Na+)=c(HCOO-),试用含a和b的代数式表示甲酸的电离常数为_____________________。
【答案】a-3/2b-2c kJ/mol 0.1 mol·L-1·min-1 加入催化剂 0.2 0.65a b·10-7/(a-b)
【解析】
(1)根据题意,利用盖斯定律,求算CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH;
CH3OH(g)+H2O(g)的ΔH;
(2)根据图像,分析得出4分钟内,甲醇的浓度变化,进而求出二氧化碳的浓度变化,再求ν(CO2);1min改变条件的结果是,速率加快,平衡时间缩短,平衡时c(CH3OH)没有改变,以此判断改变的条件,并计算平衡常数;
(3)打开K时AB组成的是等温等压容器,相应的起始投入总物质的量,与平衡总体积成正比;
(4)根据溶液中的电荷守恒,和c(Na+)=c(HCOO-)的关系,结合甲酸的电离方程式,求算甲酸的电力平衡常数。
(1)依据题给信息,①CH3OH(g)![]() 3/2O2(g)=CO2(g)
3/2O2(g)=CO2(g) ![]() 2H2O(l) ΔH=-akJ/mol, ②2H2(g)+O2(g) = 2H2O(g) ΔH= -b kJ/mol;③H2O(g)=H2O(l) ΔH= -c kJ/mol,根据盖斯定律,3/2
2H2O(l) ΔH=-akJ/mol, ②2H2(g)+O2(g) = 2H2O(g) ΔH= -b kJ/mol;③H2O(g)=H2O(l) ΔH= -c kJ/mol,根据盖斯定律,3/2![]() ②
②![]() 3
3![]() ③-①可得:CO2(g)+3H2(g)
③-①可得:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH= a-3/2b-2c kJ/mol;
CH3OH(g)+H2O(g) ΔH= a-3/2b-2c kJ/mol;
本题答案为:a-3/2b-2c kJ/mol。
(2)根据图像,分析得出4分钟内,甲醇的浓度变化,![]() c(CH3OH)=0.4mol/L,依据则v(CH3OH)=0.4mol/L/4min=0.1mol/(L·min) ,由于速率之比等于计量数之比,所以ν(CO2)= v(CH3OH)= 0.1mol/(L·min);1min时改变条件的结果是曲线I变为曲线II,速率加快,平衡时间缩短,平衡时c(CH3OH)没有改变,根据反应CO2(g)+3H2(g)
c(CH3OH)=0.4mol/L,依据则v(CH3OH)=0.4mol/L/4min=0.1mol/(L·min) ,由于速率之比等于计量数之比,所以ν(CO2)= v(CH3OH)= 0.1mol/(L·min);1min时改变条件的结果是曲线I变为曲线II,速率加快,平衡时间缩短,平衡时c(CH3OH)没有改变,根据反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH= a-3/2b-2c kJ/mol,可知改变的条件是:加入催化剂;由图像可知,平衡时c(CH3OH)=0.4mol/L,,
CH3OH(g)+H2O(g) ΔH= a-3/2b-2c kJ/mol,可知改变的条件是:加入催化剂;由图像可知,平衡时c(CH3OH)=0.4mol/L,,![]() n(CH3OH)=0.4mol/L
n(CH3OH)=0.4mol/L![]() 2L=0.8mol,c(H2O)=0.4mol/L,故由方程式可知:
2L=0.8mol,c(H2O)=0.4mol/L,故由方程式可知:![]() n(CO2)=0.8mol,平衡时c(CO2)=(2.4-0.8)/2=0.8mol/L,
n(CO2)=0.8mol,平衡时c(CO2)=(2.4-0.8)/2=0.8mol/L,![]() n(H2)=3
n(H2)=3![]() 0.8mol=2.4mol,平衡时c(H2)=(4.4-2.4)/2=1mol/L,该温度下平衡常数K= c(CH3OH)·c(H2O)/ c(CO2)·c3(H2)=0.2
0.8mol=2.4mol,平衡时c(H2)=(4.4-2.4)/2=1mol/L,该温度下平衡常数K= c(CH3OH)·c(H2O)/ c(CO2)·c3(H2)=0.2
本题答案为:0.1 mol·L-1·min-1 ; 加入催化剂 ;0.2 。
(3)打开K时AB组成的是等温等压容器,相应的起始投入总物质的量,与平衡总体积成正比,设打开K重新达到平衡,总体积为x,则有:x:(5![]() 6)=0.9a:6,解得x=1.65a,因为起始时A的体积为aL,所以重新平衡时B的体积为:1.65a-a=0.65aL;
6)=0.9a:6,解得x=1.65a,因为起始时A的体积为aL,所以重新平衡时B的体积为:1.65a-a=0.65aL;
本题答案为:0.65a。
(4)根据溶液中的电荷守恒:c(Na+)![]() c(H+)=c(HCOO-)
c(H+)=c(HCOO-)![]() c(OH-),而体系中c(Na+)=c(HCOO-),故c(H+)= c(OH-)=1
c(OH-),而体系中c(Na+)=c(HCOO-),故c(H+)= c(OH-)=1![]() 10-7mol/L,c(Na+)=c(HCOO-)=b/2mol/L,反应后溶液中剩余c(HCOOH)=(a/2-b/2)mol/L,依据HCOOH
10-7mol/L,c(Na+)=c(HCOO-)=b/2mol/L,反应后溶液中剩余c(HCOOH)=(a/2-b/2)mol/L,依据HCOOH![]() HCOO-
HCOO-![]() H+,所以甲酸的电离平衡常数为Ka=c(HCOO-)c(H+)/c(HCOOH)=
H+,所以甲酸的电离平衡常数为Ka=c(HCOO-)c(H+)/c(HCOOH)=![]() = b·10-7/(a-b);
= b·10-7/(a-b);
本题答案为:b·10-7/(a-b)。


科目:高中化学 来源: 题型:
【题目】下图表示人体细胞内化学元素所形成的化合物(①~④表示化合物),下列相关说法错误的是( )
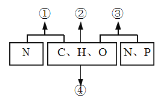
A. ①可以表示蛋白质
B. ②可以表示“生命的燃料”——葡萄糖
C. ③表示的小分子物质可能是核苷酸
D. ④是细胞膜重要的组成成分,可以表示磷脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:Ca(ClO)2 + 4HCl(浓)= CaCl2 + 2Cl2↑+ 2H2O
(1)浓盐酸在反应中显示出来的性质是 ________(填写字母)
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3molCl2,则转移的电子的物质的量为 ___________;
(3)该反应中氧化产物与还原产物的质量比为____________;
(4)用双线桥法表示该氧化还原反应中电子转移的方向和数目______
(5)铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:
①Tl3++2Ag=Tl++2Ag+,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+,下列离子氧化性比较顺序正确的是__________ (填写字母)
A.Tl3+>Fe3+>Ag+ B.Fe3+>Ag+>Tl3+ C.Tl+>Ag+>Fe2+ D.Tl3+>Ag+>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钾是一种重要的无机氟化工产品,广泛应用于医药、农药和金属冶炼等领域。采用湿法磷酸副产物氟硅酸(![]() ,含有少量
,含有少量![]() 、
、![]() 等)制备氟化钾的工艺流程如图所示(已知:
等)制备氟化钾的工艺流程如图所示(已知:![]() ):
):

请回答下列问题:
(1)碱解过程主要反应的化学方程式为_____,其中要严格控制KOH用量,否则易生成副产物_____(填化学式)溶解在滤液中。
(2)碱解反应中温度对氟化钾收率的影响如图所示。由如图可知,实验选择适宜的反应温度为____;最高点后,随温度升高曲线下降的原因可能是_______。

(3)Ba(OH)2加入量对![]() 含量和氟化钾纯度的影响如图所示。当
含量和氟化钾纯度的影响如图所示。当![]() 由0.004到0.005时,氟化钾的纯度升高,这是由于__。
由0.004到0.005时,氟化钾的纯度升高,这是由于__。
(4)Ba(OH)2和BaCO3是常见的除硫试剂。若使用BaCO3代替Ba(OH)2,当沉淀转化达到平衡时,滤液中![]() ___[已知
___[已知![]() ,
,![]() ,保留小数点后三位]。
,保留小数点后三位]。
(5)浓度均为0.1mol/L的KF和HF的混合溶液中:2c(H+)-2c(OH-)____c(F-)-c(HF) (填“>”“<”或“=”)。
(6)1986年,化学家Karl Chrite用KMnO4和KF、HF混合溶液反应生成稳定配离子![]() ,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,CH3COOH的电离常数Ka=1.8×10-5。常温下,往25ml氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,pH变化曲线如下图所示:
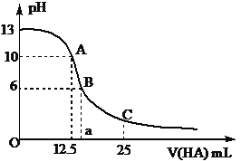
(1)该氢氧化钠溶液的物质的量浓度为________mol·L-1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH-)=____ mol·L-1。
(3)B点所示溶液中,c(CH3COO-)-c(Na+)=_______________ mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=_______。
(4)C点所示溶液中,c(CH3COOH)_______c(CH3COO-)。(填“>”、“<”或“=”)
(5)向300 mL上述NaOH溶液中通入448 mL CO2(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是________.
A.c(Na+)+ c(H+)= c(OH-)+ c(HCO3-)+ c(CO32-)
B.2/3c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
D.c(Na+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把氢氧化钙放入蒸馏水中,一定时间后达到下列溶解平衡:Ca(OH)2 (s) ![]() Ca2+(aq) + 2OH-(aq),加入下列固体物质,可使Ca(OH)2固体减少的是( )
Ca2+(aq) + 2OH-(aq),加入下列固体物质,可使Ca(OH)2固体减少的是( )
A. CaCl2 B. NaHCO3 C. NaOH D. NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒熔点高、硬度大,具有良好的可塑性和低温抗腐蚀性.工业常用钒炉渣(主要含FeO·V2O3,还有少量Al2O3、CuO等杂质)提取金属钒,流程如图:

已知:
I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡:VO2++H2OVO3+2H+.
Ⅱ.部分离子的沉淀pH:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀PH | 5.2 | 7.6 | 2.7 |
完全沉淀PH | 6.4 | 9.6 | 3.7 |
回答下列问题
(1)碱浸步骤中最好选用______________(填字母)
a. NaOH溶液 b.氨水c.纯碱溶液
(2)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价的氧化物,写出该反应的化学方程式___________________________________
(3)溶液1到溶液2的过程中,调节pH至8有两个目的,一是除去________离子,二是促使_________.
(4)沉钒过程中得到NH4VO3沉淀需要洗涤,写出实验室洗涤的操作方法____________________.
(5)常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式____________________________.
(6)钒的化合物也有广泛的用途,如一种新型铝离子可充电电池的结构如图所示.
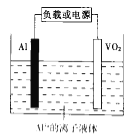
已知放电时电池反应为xAl+VO2=AlxVO2↓,则放电时正极的电极反应式为_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清洁能源的开发、废水的处理都能体现化学学科的应用价值。
Ⅰ. 工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
反应B:CO2(g)+H2![]() H2O(g)+CO(g) △H2=+41kJ·mol-1
H2O(g)+CO(g) △H2=+41kJ·mol-1
⑴ 写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式: __________________。
⑵ 反应A可自发进行的温度条件是________(填“低温”或“高温”) 。
⑶ 写出两个有利于提高反应A中甲醇平衡产率的条件___________。
⑷ 在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

温度对反应的影响 压强对反应的影响
① 由上图可知,影响产物选择性的外界条件是______。
A. 温度 B. 压强 C. 催化剂
② 如图中M点温度为250℃,CO2的平衡转化率为25%,该温度下反应B的平衡常数为________________(用分数表示)。
Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。

⑸ 阳极反应式为__________________________________。
⑹ 除去NH4+的离子反应方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A. 1L 1mol/L CH3COONa 溶液中含有 CH3COO-的数目为 NA
B. 100 ml 1.0 mol·L-1 FeCl3 溶液与足量 Cu 反应,转移的电子数为 0.2NA
C. 标准状况下,11.2 L CCl4 中含有 C—Cl 键的数目为 2NA
D. NA 个 D2O 分子中,含有 10NA 个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com