
【题目】原电池是将化学能转化为电能的装置。分析甲、乙两原电池装置,回答下列问题:

(1)甲、乙两装置中铜电极都产生大量的无色气泡,则Cr电极是______极,Cu电极表面发生反应的电极反应式为_______;与甲装置相比,乙装置的优点是________________,原因是_________。
(2)如果将甲装置中的稀硫酸改为浓硝酸,则铜电极上无气体产生,而铬电极上产生大量的有色气体。由(1)、(2)两个实验推测金属Cr具有的两点化学性质______________________________。
【答案】负 2H+ + 2e- = H2↑ 能量转化率高 Cr不和H+接触,不会直接将电子给予H+ Cr的还原性比H2强,Cr遇浓硝酸钝化
【解析】
(1)由题给信息可知,单质的还原性Cr>Cu,在原电池中,Cr电极是负极,发生氧化反应,Cu电极是正极,发生还原反应;使用盐桥,隔绝了Cr和稀硫酸的接触,Cr和稀硫酸不会直接反应,提高了化学能转化为电能的效率;
(2)如果将甲装置中的稀硫酸改为浓硝酸,则铜电极上无气体产生,而铬电极上产生大量的有色气体,说明Cu电极是负极,发生氧化反应, Cr电极是正极,发生还原反应。
(1)甲、乙两装置中铜电极都产生大量的无色气泡,说明单质的还原性Cr>Cu,在原电池中,Cr电极是负极,发生氧化反应,Cu电极是正极,发生还原反应,电极反应式为2H+ + 2e- = H2↑;由装置图可以看出,乙装置使用了盐桥,隔绝了Cr和稀硫酸的接触,Cr和稀硫酸不会直接反应,减少了化学能转变为热能的损耗,提高了化学能转化为电能的效率,故答案为:负;2H+ + 2e- = H2↑;能量转化率高;Cr不和H+接触,不会直接将电子给予H+;
(2)如果将甲装置中的稀硫酸改为浓硝酸,则铜电极上无气体产生,而铬电极上产生大量的有色气体,说明Cu电极是负极,发生氧化反应, Cr电极是正极,发生还原反应,结合浓硝酸的强氧化性,不难推测铬被浓硝酸钝化,导致活性降低,故答案为:Cr的还原性比H2强;Cr遇浓硝酸钝化。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )

A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名的获得诺贝尔奖的狄尔斯—阿德尔反应,是由共轭双烯与烯烃或炔烃反应生成六元环的反应。如:
 (可表示为
(可表示为![]() ),实际是个加成反应。
),实际是个加成反应。
工业上常用下列流程制取重要化学原料![]() (M)。
(M)。

流程中的A为天然橡胶的单体,分子式为C5H8。
(1)A的名称是______,B的结构简式是______。
(2)A的属于炔烃的同分异构体一共有____种,A与B反应生成的另一种含六元环的化合物的结构简式为________。
(3)②反应的类型为_____,③反应的化学方程式为:________。
(4)按下列要求写出B的两种同分异构体的结构简式:__________。
(Ⅰ)能发生银镜反应;(Ⅱ)分子结构中含有两个甲基;(Ⅲ)能发生水解反应
(5)由丙烯制得B经如下流程:

参照流程中的前两步和最后一步的书写方法写出其他中间步骤的流程:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种用途广泛的无机化工原料,一种以氧化铜矿(CuO,含有Fe2O3、Al2O3、SiO2杂质)为原料制备Cu2O的流程如图所示:

已知氨浸过程中仅发生的反应为:CuO+4NH3·H2O= [Cu(NH3)4]2++2OH-+3H2O
回答下列问题:
(1)氨浸之前需将矿物粉碎、过筛,目的是_______________________________。
(2)氨浸时的温度一般不超过30℃,主要原因是__________________。按此工艺,能否用NaOH溶液代替氨水?__________________(填“能”或“否”)。
(3)蒸馏过程中会生成一种黑色固体,则此过程中发生反应的化学方程式为____________。
(4)电解过程中阳极的电极反应式为_________________。
(5)Cu(OH)2也可与NH3·H2O反应,已知常温下:
Cu(OH)2(s)+4NH3·H2O(aq)![]() [Cu(NH3)4]2+(aq)+2OH-(aq)+4H2O(l) K1=4.4×10-7
[Cu(NH3)4]2+(aq)+2OH-(aq)+4H2O(l) K1=4.4×10-7
Cu2+(aq)+4NH3·H2O(aq)![]() [Cu(NH3)4]2+(aq)+4H2O(l) K2=2.0×1013
[Cu(NH3)4]2+(aq)+4H2O(l) K2=2.0×1013
则常温下Ksp[Cu(OH)2]=________________。
(6)为了尽量减少流程中所用原料的种类,还原过程可用气体A代替气体B,在加热条件下生成两种单质,该反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s) ![]() 2CO(g),达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g),达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A. 平衡常数:K(Ⅰ) > K (Ⅱ)
B. 在T1K时,在1.0L恒容容器中加入足量碳粉、0.09molCO2、0.05molCO,此时υ正 >υ逆
C. 体系的总压强p:p(Ⅱ) >2p(Ⅰ)
D. 正反应速率:υ正(Ⅰ) >υ正(Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的二元弱酸,还是一种重要的还原剂。草酸及草酸盐在工农业生产及科学研究领域均有广泛应用。
(1)请设计实验证明草酸为二元酸___________________________。
(2)已知草酸氢钾(KHC2O4)溶液显酸性,请结合必要的化学用语解释KHC2O4溶液显酸性的原因 ________。
(3)利用草酸及草酸盐的性质可测定人体血液中钙离子的浓度。方法如下:抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸,再用已知浓度的酸性KMnO4溶液滴定,使草酸转化成CO2逸出,根据消耗的KMnO4溶液的体积即可测定血液样品中Ca2+的浓度。
①写出草酸与酸性KMnO4溶液反应的离子方程式______________。
②抽取血样10.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.010mol/L KMnO4溶液滴定。在向滴定管中注入KMnO4标准溶液前,滴定管需要检漏、____和___。确定反应达到终点的现象是__。
③滴定结束共消耗12.00mL KMnO4溶液。则血液样品中Ca2+离子的浓度为______mg/mL。
④下列操作可能使所测定结果偏高的是_________。
A.酸式滴定管未用标准液润洗就直接注入酸性高锰酸钾溶液
B.滴定前盛放待测液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定结束后读取标准液体积时,俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示人体细胞内化学元素所形成的化合物(①~④表示化合物),下列相关说法错误的是( )
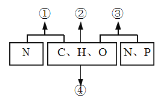
A. ①可以表示蛋白质
B. ②可以表示“生命的燃料”——葡萄糖
C. ③表示的小分子物质可能是核苷酸
D. ④是细胞膜重要的组成成分,可以表示磷脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钾是一种重要的无机氟化工产品,广泛应用于医药、农药和金属冶炼等领域。采用湿法磷酸副产物氟硅酸(![]() ,含有少量
,含有少量![]() 、
、![]() 等)制备氟化钾的工艺流程如图所示(已知:
等)制备氟化钾的工艺流程如图所示(已知:![]() ):
):

请回答下列问题:
(1)碱解过程主要反应的化学方程式为_____,其中要严格控制KOH用量,否则易生成副产物_____(填化学式)溶解在滤液中。
(2)碱解反应中温度对氟化钾收率的影响如图所示。由如图可知,实验选择适宜的反应温度为____;最高点后,随温度升高曲线下降的原因可能是_______。

(3)Ba(OH)2加入量对![]() 含量和氟化钾纯度的影响如图所示。当
含量和氟化钾纯度的影响如图所示。当![]() 由0.004到0.005时,氟化钾的纯度升高,这是由于__。
由0.004到0.005时,氟化钾的纯度升高,这是由于__。
(4)Ba(OH)2和BaCO3是常见的除硫试剂。若使用BaCO3代替Ba(OH)2,当沉淀转化达到平衡时,滤液中![]() ___[已知
___[已知![]() ,
,![]() ,保留小数点后三位]。
,保留小数点后三位]。
(5)浓度均为0.1mol/L的KF和HF的混合溶液中:2c(H+)-2c(OH-)____c(F-)-c(HF) (填“>”“<”或“=”)。
(6)1986年,化学家Karl Chrite用KMnO4和KF、HF混合溶液反应生成稳定配离子![]() ,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com