
����Ŀ�����Ȼ�����ӡˢ��ҽҩ�����ϡ���ˮ�����Լ��л��ϳɴ�����������Ҫ��Ӧ�á���ҵ�ϳ��Է���м������SiO2��Al2O3��MgO��Fe2O3�����ʣ�Ϊԭ���Ʊ��Ȼ�����������������ͼ��

��֪�����������Ksp�±���
�������� | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 1.0��10-36 | 1.6��10-14 | 2.0��10-33 | 1.2��10-11 |
��ش��������⣺
��1������X���ѡ�����������е�____��ѡ����ţ�������X��Ŀ����_________��
A��KMnO4 B��FeCl3 C��H2O2 D��HNO3
��2����Һ�����NaOH��Һ��Ŀ���ǵ�����Һ��pH����֪��Һ����c(Fe3+)Ϊ1.0mol��L-1��c(Al3+)Ϊ0.03mol��L-1����Fe3+������ȫʱ��c(Fe3+)Ϊ1��10-5mol��L-1����Al3+�Ƿ��Ѿ���ʼ��������ͨ������˵��______________��
��3��д������1��NaOH��Һ��Ӧ�����ӷ���ʽ_____________________��
��4������2�мӹ��������Ŀ����_____________________________��
��5��FeCl3���о�ˮ���ã�����ʴ�豸�����ۺ��Ȼ�����һ�����͵���������������ˮ��FeCl3��Ч���Ҹ�ʴ��С��
��FeCl3��ˮ��ԭ����________��FeCl3��Һ��ʴ�����豸����H�������⣬��һ��Ҫԭ���ǣ������ӷ���ʽ��ʾ��_________��
��FeCl3����Һ�з�����ˮ�⣺Fe3����H2O![]() Fe(OH)2����H����K1��Fe(OH)2����H2O
Fe(OH)2����H����K1��Fe(OH)2����H2O![]() Fe(OH)2+��H����K2��Fe(OH)2+��H2O
Fe(OH)2+��H����K2��Fe(OH)2+��H2O![]() Fe(OH)3��H����K3������ˮ�ⷴӦ��ƽ�ⳣ��K1��K2��K3�ɴ�С��˳����_______��
Fe(OH)3��H����K3������ˮ�ⷴӦ��ƽ�ⳣ��K1��K2��K3�ɴ�С��˳����_______��
��ͨ����������������ˮ�����ۺϣ����ɾۺ��Ȼ��������ӷ���ʽΪxFe3����yH2O![]() Fex(OH)y(3x-y)+��yH������ʹƽ�������ƶ��ɲ��õķ����ǣ�����ţ�_____��
Fex(OH)y(3x-y)+��yH������ʹƽ�������ƶ��ɲ��õķ����ǣ�����ţ�_____��
a�����¡� b����ˮϡ�� c������NH4Cl d������NaHCO3
�����£�ʹ�Ȼ�����Һת��Ϊ��Ũ�Ⱦۺ��Ȼ����Ĺؼ�������___________��
���𰸡�C ʹFe2+������Fe3+ Fe3+������ȫʱ����Һ��c3(OH-)��1.0��10-36/(1��10-5)=1��10-31��
Qsp[Al(OH)3]��c(Al3+)��c3(OH-)=0.03��1��10-31=3��10-33��Ksp[Al(OH)3]������Al(OH)3�ѿ�ʼ���� Al(OH)3 + OH- = AlO2- + 2H2O ʹFe(OH)3ת��ΪFeCl3����ֹFe3+ˮ�� Fe3��ˮ�����ɵ�Fe(OH)3��������������ˮ������������ 2Fe3����Fe=3Fe2�� K1>K2>K3 b��d ������Һ��pH
��������
�����̿�֪������м������SiO2��Al2O3��MgO��Fe2O3�����ʣ��������ᣬ���˵ĵõ�����Fe2+��Fe3+��Al3+��Mg2+����Һ������Һ������ʵ�����������Fe2+������Fe3+���ټ���NaOH��Һ������Һ��pHʹFe3+��ȫ������������Һ��pH��ֹMg2+���������ˣ��������м������NaOH��Һ����ȥ�����е��������������˵õ������������������������������м���������ᣬʹ���������ܽ�ת��ΪFeCl3��Һ��������������Է�ֹFe3+ˮ����FeCl3��Һ���Ȼ��������м������ɵõ���ˮFeCl3��
��1������������XʹFe2+������Fe3+ʱ����ò������µ����ʣ�����˫��ˮ�Ļ�ԭ������ˮ������X���ѡ��˫��ˮ���ʴ�Ϊ��C��ʹFe2+������Fe3+��
��2����Fe3+������ȫʱ��c(Fe3+)Ϊ1��10-5mol��L-1������Һ��c3(OH-)�� 1.0��10-36/(1��10-5)=1��10-31����Һ��Qsp[Al(OH)3]��c(Al3+)��c3(OH-)=0.03��1��10-31=3��10-33��Ksp[Al(OH)3]������Al(OH)3�ѿ�ʼ�������ʴ�Ϊ��Fe3+������ȫʱ����Һ��c3(OH-)��1.0��10-36/(1��10-5)=1��10-31��Qsp[Al(OH)3]��c(Al3+)��c3(OH-)=0.03��1��10-31=3��10-33��Ksp[Al(OH)3]������Al(OH)3�ѿ�ʼ������
��3������1�м�NaOH��Һ��Ŀ���dz�ȥ�����е�������������������������������������������Һ��Ӧ����ƫ�����ƺ�ˮ����Ӧ�����ӷ���ʽΪ��Al(OH)3 + OH- = AlO2- + 2H2O���ʴ�Ϊ��Al(OH)3 + OH- = AlO2- + 2H2O��
��4������2�мӹ����������ʹ���������ܽ�ת��ΪFeCl3��Һ��������������Է�ֹFe3+ˮ�⣬�ʴ�Ϊ��ʹFe(OH)3ת��ΪFeCl3����ֹFe3+ˮ����
��5����FeCl3����Һ��ˮ����������������������ᣬ��������������кܴ�ı�������ܹ�����ˮ�����������ʣ��ﵽ��ˮ��Ŀ�ģ�FeCl3��Һ��ʴ�����豸����H�������⣬Fe3+���������ԣ�����Fe��ӦFe2+���ɸ�ʴ�豸����Ӧ�����ӷ���ʽΪ2Fe3����Fe=3Fe2�����ʴ�Ϊ��Fe3��ˮ�����ɵ�Fe(OH)3��������������ˮ��������������2Fe3����Fe=3Fe2����
��FeCl3����Һ�з�����ˮ�����Ե�һ��Ϊ�����ҵ�һ��ˮ�����Ƶڶ���ˮ�⣬��һ������ˮ�����Ƶ�����ˮ�⣬ˮ�ⷴӦ��ƽ�ⳣ��K1��K2��K3�ɴ�С��˳����K1>K2>K3���ʴ�Ϊ��K1>K2>K3��
����ˮ�����ӷ���ʽxFe3����yH2O![]() Fex(OH)y(3x-y)+��yH����֪����ʹƽ�������ƶ�Ӧ����ϡ�ͷ�����������Һ�м�������H����Ӧ�����ʣ���ѡb��d�������£�ʹ�Ȼ�����Һת��Ϊ��Ũ�Ⱦۺ��Ȼ����Ĺؼ������ǵ�����Һ��pH����Ҫ�ٽ�ˮ�⣬��Ҫ��ֹˮ����ȫ���������������壬�ʴ�Ϊ��b��d��������Һ��pH��
Fex(OH)y(3x-y)+��yH����֪����ʹƽ�������ƶ�Ӧ����ϡ�ͷ�����������Һ�м�������H����Ӧ�����ʣ���ѡb��d�������£�ʹ�Ȼ�����Һת��Ϊ��Ũ�Ⱦۺ��Ȼ����Ĺؼ������ǵ�����Һ��pH����Ҫ�ٽ�ˮ�⣬��Ҫ��ֹˮ����ȫ���������������壬�ʴ�Ϊ��b��d��������Һ��pH��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����;�㷺�ľ�ϸ������Ʒ����ҵ�������������ķ����ܶ࣬��ͼ��

����˵����ȷ����
A. ��Ӧ�١��ھ���ȡ����Ӧ
B. ��Ӧ�ۡ��ܵ�ԭ�������ʾ�Ϊ100��
C. ������������Ϊͬ���칹������������2��
D. �Ҵ������ᡢ��������������ɫҺ�����Na2CO3��Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��2NO2(g)![]() 2NO(g)+O2(g)�ں����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�Ǣٵ�λʱ��������n molO2 ��ͬʱ���� 2n mol NO���ڵ�λʱ��������2n molNO2��ͬʱ����n molO2���ۻ���������ɫ���ٸı��״̬����2v(NO2)��= v(O2)�����ݻ�������ƽ����Է����������ٸı��״̬�����������ܶȲ��ٸı��״̬
2NO(g)+O2(g)�ں����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�Ǣٵ�λʱ��������n molO2 ��ͬʱ���� 2n mol NO���ڵ�λʱ��������2n molNO2��ͬʱ����n molO2���ۻ���������ɫ���ٸı��״̬����2v(NO2)��= v(O2)�����ݻ�������ƽ����Է����������ٸı��״̬�����������ܶȲ��ٸı��״̬
A. �٢ۢ� B. �ڢܢ� C. �٢ۢܢ� D. �٢ڢۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ1.0 L���������ܱ������м�����������ͬ��̼�ۣ��ٷֱ����0.1 mol CO2��0.2 mol CO2���ڲ�ͬ�¶��·�ӦCO2(g)��C(s) ![]() 2CO(g)���ﵽƽ�⣬ƽ��ʱc(CO2) ���¶ȵı仯��ͼ��ʾ��ͼ�Т������������ϣ�������˵����ȷ����
2CO(g)���ﵽƽ�⣬ƽ��ʱc(CO2) ���¶ȵı仯��ͼ��ʾ��ͼ�Т������������ϣ�������˵����ȷ����

A. ƽ�ⳣ����K(��) �� K (��)
B. ��T1Kʱ����1.0L���������м�������̼�ۡ�0.09molCO2��0.05molCO����ʱ���� ������
C. ��ϵ����ѹǿp��p(��) ��2p(��)
D. ����Ӧ���ʣ�����(��) ������(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʾ���ʵ��Ʊ�������������
A. ʵ���ҴӺ�������ȡ���ʵ�ȡ�����������ܽ�����������ȡ������
B. ���ʯ(��Ҫ�ɷ�TiO2)Ϊԭ����������Ti�����ʯ����̿![]() TiCl4
TiCl4![]() Ti
Ti
C. ��±ˮ��(������Ҫ��MgCl2)��ȡMg
±ˮ![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl(s)
MgCl(s) ![]() Mg
Mg
D. ��ʳ����ȡƯ�۾�NaCl(ag) ![]() Cl2
Cl2![]() Ư�۾�
Ư�۾�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ϸ���ڻ�ѧԪ�����γɵĻ�����١��ܱ�ʾ��������������˵����������(����)
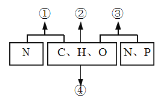
A. �ٿ��Ա�ʾ������
B. �ڿ��Ա�ʾ��������ȼ�ϡ�����������
C. �۱�ʾ��С�������ʿ����Ǻ�����
D. ����ϸ��Ĥ��Ҫ����ɳɷ֣����Ա�ʾ��֬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦA(g)![]() B(g) 2C(g)��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
B(g) 2C(g)��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶�/�� | 700 | 800 | 830 | 1000 | 1200 |
ƽ�ⳣ�� | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
�ش��������⣺
(1)�÷�Ӧ��ƽ�ⳣ������ʽK![]() ____________��
____________��![]() ______0(�������������������P��)
______0(�������������������P��)
(2)�ݻ��̶����жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ_______(����ȷѡ��ǰ����ĸ)��
a��������ܶȲ���ʱ��ı�
b��![]() (A)����ʱ��ı�
(A)����ʱ��ı�
c���������ƽ����Է�����������ʱ��ı�
d��ѹǿ����ʱ��ı�
(3)1200��ʱ��Ӧ2C(g) ![]() A(g)
A(g)![]() B(g)��ƽ�ⳣ��ֵΪ____________��
B(g)��ƽ�ⳣ��ֵΪ____________��
(4)830��ʱ����һ��10.00L���ܱ������г���0.40 mol��A��1.60 mol��B�������Ӧ��ʼ2s������C�����ʵ���Ϊ0.40 mol����2s��A��ƽ����Ӧ����![]() (A)=____________
(A)=____________
mol��L��1��s��1��2sʱ![]() (B)= ___________mol��L��1��2sʱA��ת����Ϊ___________��2sʱC���������Ϊ_______________��
(B)= ___________mol��L��1��2sʱA��ת����Ϊ___________��2sʱC���������Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������(C6HnO7)2Fe����ҽ���ϳ��õIJ�������������ˮ,������������ ����ijʵ��С��ͬѧ������ͼװ�����Ʊ�FeCO3,����FeCO3���������ᷴӦ��һ���Ƶ���������������

��ش��������⣺
(1) ����ͨ©���Ƚ�,a©�����ŵ���______________
(2)����ͼ���Ӻ�װ�ã���������Ժ����ҩƷ����K1��K3,�ر�K2 .
��b�е�ʵ������____________________
��һ��ʱ��ر�_____����______(ѡ��K1 ,K2��K3)���۲쵽b�е���Һ������c�У�ͬʱc������FeCO3������
��b����������������______________________________.
(3)��c���Ƶõ�̼�������ڿ����й���ʱ��ϳ�ʱ��������Ϊ���ɫ���û�ѧ����ʽ˵����ԭ��.____________________________________
(4)������������̼��������ϣ��뽫��Һ��pH������5.8,��ԭ���� _______.
��������Һ�м����Ҵ�����������Ʒ�������Ҵ���Ŀ����_______________��
(5)��ͬѧ�����NaHCO3��Һ����Na2CO3��Һ�Ƶõ�̼���������ȸ��ߣ�����ܵ�ԭ����________________________________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��CH3COOH�ĵ��볣��Ka=1.8��10-5��������,��25ml�������Ʊ���Һ����μ���0.2 mol��L��1��CH3COOH��Һ��pH�仯��������ͼ��ʾ��
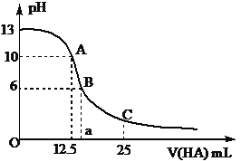
��1��������������Һ�����ʵ���Ũ��Ϊ________mol��L��1��
��2��A���Ӧ������Ϊ12.5ml�������û����Һ����ˮ�������c(OH��)��____ mol��L��1��
��3��B����ʾ��Һ�У�c(CH3COO��)��c(Na��)��_______________ mol��L��1(�ȷֵ)��c(CH3COO��)/c(CH3COOH)��_______��
��4��C����ʾ��Һ�У�c(CH3COOH)_______c(CH3COO��)��(������������������������)
��5����300 mL����NaOH��Һ��ͨ��448 mL CO2(��״��)���壬��ַ�Ӧ����Һ������Ũ�ȹ�ϵ��ȷ����________.
A��c(Na+)+ c(H+)= c(OH-)+ c(HCO3-)+ c(CO32-)
B��2/3c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C��c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
D��c(Na+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com