
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):NN为942、OO为500、NN为154,则断裂1 mol NH键所需的能量(kJ)是( )

A.194 B.391
C.516 D.658
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
( )
A.20 mL 10 mol/L的浓硫酸与足量铜反应转移电子数为0.2NA
B.1 mol/L FeCl3溶液中Fe3+的数目小于NA
C.在精炼铜或电镀铜过程中,当阴极析出32 g铜时,转移电子数为NA
D.标准状况下,0.1NA个SO3的体积约为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生如下离子反应(未配平):
Mn2++S2O +H2O→MnO
+H2O→MnO +SO
+SO +H+;
+H+;
①该反应常用于检验Mn2+的存在,其特征现象是
________________________________________。
②若反应中有0.1 mol还原剂参加反应,则转移电子数为________NA,消耗氧化剂的物质的量_____________________________________mol。
③写出该反应的离子方程式_________________________________。
(2)①向CuSO4溶液中通入硫化氢生成黑色沉淀CuS的离子方程式为
__________________________________________________;
②向FeCl3溶液中加入过量的碘化钠溶液的离子方程式为_____________。
(3)在碱性介质中,H2O2有较强的还原性,可与Ag2O反应,该反应中氧化剂与还原剂的物质的量之比为_______________________________________。
(4)为测定大气中的臭氧(O3)含量,将0℃、1.01×105 Pa的空气V L慢慢通入足量KI溶液,使臭氧完全反应;然后将所得溶液用a mL c mol·L-1的Na2S2O3溶液进行滴定,恰好达到终点。已知:2Na2S2O3+I2===Na2S4O6+2NaI。
①该滴定过程中可选择的指示剂为________。
②O3与KI溶液反应生成两种单质,则反应的化学方程式为
________________________________________________________。
③空气中臭氧的体积分数为________(用含“a、c、V”的字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
两烧杯中分别加入足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为
A.1︰2 B.3︰2 C.3︰1 D.6︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
加强空气质量检测,客观分析空气中污染物的来源及性质,将有助于制定有针对性的治理措施。下表是某城市某日的空气质量报告:
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
(1)用下图所示装置进行实验。
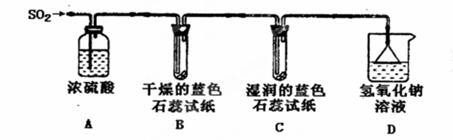
①A装置的作用是____________________。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊
试纸变成________________色,说明SO2与水反应生成一种酸,其化学反应方程式是 。
③D装置的作用是__________________________________________________,
D中发生反应的化学方程式是_________________________________________。
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH________7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐_______(填“变大”或“变小”), 直至恒定,原因是 (写出反应的离子方程式)。
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4, 则在此过程中的飘尘是作为___________(填“催化剂”或“氧化剂”)。
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为__________________,是造成酸雨的另一主要原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①H2O(g)===H2O(l)
ΔH1=-Q1 kJ·mol-1
②C2H5OH(g)===C2H5OH(l)
ΔH2=-Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g)
ΔH3=-Q3 kJ·mol-1
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)( )
A.Q1+Q2+Q3
B.1.5Q1-0.5Q2+0.5Q3
C.0.5Q1-1.5Q2+0.5Q3
D.0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源: 题型:
在元素周期表中,位于金属元素和非金属元素交界处最容易找到的材料是( )
A.制催化剂的材料 B.耐高温、耐腐蚀的合金材料
C.制农药的材料 D.半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组进行“活泼金属与酸反应”的实验,
将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,下
图为反应产生氢气速率与反应时间的关系图。
(1)关于图像的描述不正确的是 (填序号,下同)。
 ① a → b段产生H2加快可能是表面的氧化膜逐渐溶解,
① a → b段产生H2加快可能是表面的氧化膜逐渐溶解,
加快了反应速率
② b → c段产生H2较快可能是该反应放热,导致温度升高,加快了反应
③ c以后,产生H2速率逐渐下降可能是铝片趋于消耗完全
(2)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL
0.5 mol·L-1硫酸的快,可能的原因是________。
①盐酸中c(H+)的浓度更大 ②Cl-有催化作用
③SO42-有催化作用 ④SO42-有阻化作用(使反应变慢)
⑤Al3+有催化作用
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:
①加入某种催化剂 ②加入蒸馏水
③将铝片换成铝粉 ④增加硫酸的浓度至18 mol/L
⑤ ⑥ 。
以上方案不合理的有 ;请你再补充两种合理方案,填入空白⑤⑥处。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某反应aA(g)+ bB(g) 2C(g)的各物质浓度数据如下:
2C(g)的各物质浓度数据如下:
| A | B | C | |
| 起始浓度(mol/L) | 3.0 | 1.0 | 0 |
| 2s末浓度(mol/L) | 1.8 | 0.6 | 0.8 |
据此可推算出上述方程式中各物质的化学计量数之比是( )
A. 9:3:4 B. 3:1:2
C. 2:1:3 D. 3:2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com