
【题目】括号内物质为杂质,下列除去杂质的方法不正确的是( )
A. 乙酸乙酯(乙酸):用NaOH溶液洗涤后分液
B. 乙烷(乙烯):用溴水洗气
C. 溴苯(溴):用NaOH溶液洗涤后分液
D. 乙醇(水):先加生石灰后蒸馏
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=;若其他条件不变,容器体积缩小为1L,则K值 . (增大、减小或不变);若K300°C>K350°C , 则该反应是热反应.
(2)用O2表示从0~2s内该反应的平均速率v=;
(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=﹣226kJ/mol
O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.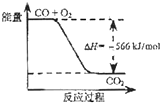
如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福莫特罗是一种治疗哮喘病的药物,它的关键中间体(G)的合成路线如下: 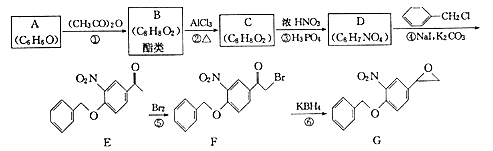
回答下列问题:
(1)F中的含氧官能团有(填名称);反应④的反应类型为 .
(2)反应①的化学方程式为 .
(3)C能与FeCl3溶液发生显色反应,C的结构简式为;D的结构简式为 .
(4)B的同分异构体(不含立体异构)中能同时满足下列条件的共有种. a.能发生银镜反应 b.能与NaOH溶液发生反应 c.含有苯环结构
其中核磁共振氢谱显示为4组峰,且峰面积比为3:2:2:1的是(填结构简式)
(5)参照G的合成路线,设计一种以 ![]() 为起始原料制备
为起始原料制备 ![]() 的合成路线:
的合成路线:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:
(1)碘化亚铁溶液的制备:将碘和铁粉按物质的量之比在 ![]() ﹣
﹣ ![]() 之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2 , 在40﹣60℃下搅拌反应30﹣50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液. ①配料中铁粉过量的目的是;持续通入N2的目的是 .
之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2 , 在40﹣60℃下搅拌反应30﹣50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液. ①配料中铁粉过量的目的是;持续通入N2的目的是 .
②检验反应液中不含碘单质的方法是 .
(2)碘化钠溶液的制备:将制备好的碘化亚铁溶液加入碳酸氢钠溶液中,控制碘化亚铁与碳酸氢钠的物质的量之比在 ![]() ∽
∽ ![]() ,在80﹣100℃下,反应30﹣50min,反应生成碘化钠及硫酸亚铁等.该反应的化学方程式为 .
,在80﹣100℃下,反应30﹣50min,反应生成碘化钠及硫酸亚铁等.该反应的化学方程式为 .
(3)点化钠的提纯与结晶: ①除去碘化钠溶液中以HCO3﹣的方法是 .
②从碘化钠溶液中获得碘化钠晶体(20℃时溶解度为179/100g水,100℃时溶解度为302/100g水)的操作方法是 .
(4)碘化钠的提度的测定: 该小组同学称取制得的碘化钠晶体18.1g,溶于水后加入50mL2.5mol/LAgNO3溶液,过滤、洗涤、干燥,称得沉淀的质量为28.2g.则碘化钠晶体的纯度为 . (杂质不参与反应,结果保留至小数点后两位)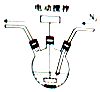
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图1是细胞中3种化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示正常细胞,则A、B化合物共有的元素中含量最多的是a
B. 若图1表示细胞完全脱水后化合物含量的扇形图,则A化合物中含量最多的元素为图2中的b
C. 图2的正常细胞中数量最多的元素是c,这与细胞中含量最多的有机物有关
D. 若图1表示正常细胞,则B化合物具有多样性,其必含的元素为C、H、O、N、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气的制取、储存和利用一直是化学领域研究的热点.H2O热分解可以得到H2和O2 , 高温下水分解体系中主要气体的体积分数与温度的关系如图所示.下列有关说法正确的是( ) 
A.图中A,B表示的粒子依次是O和H
B.图中A,B表示的粒子依次是H+和O2﹣
C.图中A,B重新生成水时的活化能等于0
D.图中A,B重新生成水时的活化能大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( ) 
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 5 mol氢 B. 氢氧根离子的摩尔质量为17 g
C. 0.1 mol H 2 O分子约含6.02×10 22 个分子 D. 氩气的摩尔质量在数值上等于它的相对原子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com