
【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ.已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
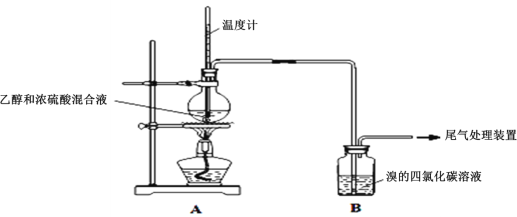
操作 | 现象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有___性。
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是___;
②乙根据现象认为实验中产生的SO2和___,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)
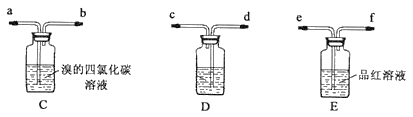
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是___;乙设计的实验D中盛放的试剂是___,装置连接顺序为___ (用仪器接口字母编号)。
b.能说明确实是SO2使E中溶液褪色的实验是___。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是___。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色。
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
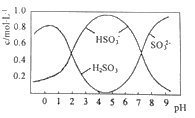
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序___。
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤___mol·L-1。
【答案】脱水性 Na2SO3+H2SO4(浓)=Na2SO3+SO2↑+H2O或Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O H2O NaOH溶液 浓硫酸 dcabef 加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2 .Br2+SO2+2H2O==4H++2Br-+SO42-、SO42-+Ba2+==BaSO4↓或Br2+SO2+2H2O+Ba2+=4H++2Br-+BaSO4↓ c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) 0.05
CuSO4+SO2↑+2H2O H2O NaOH溶液 浓硫酸 dcabef 加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2 .Br2+SO2+2H2O==4H++2Br-+SO42-、SO42-+Ba2+==BaSO4↓或Br2+SO2+2H2O+Ba2+=4H++2Br-+BaSO4↓ c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) 0.05
【解析】
(1)浓硫酸具有脱水性、吸水性和强氧化性,能使乙醇碳化;
(2)①实验室用Cu与浓硫酸加热制取SO2;
②溴单质可以和二氧化硫发生氧化还原反应;
③a、氢氧化钠可以和二氧化硫发生反应;浓硫酸具有吸水性,可以做干燥剂;根据乙的设计,即要证明干燥的二氧化硫不能使溴的四氯化碳褪色,但能使品红褪色,据此确定装置连接顺序;
b、二氧化硫使品红褪色,受热时又恢复红色,根据这一性质判断是否为二氧化硫使品红褪色;
c、溴单质可以和二氧化硫发生氧化还原反应,硫酸根离子和钡离子反应会生成白色沉淀;
(3)根据图可以知道,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,再结合图得到溶液中离子大小关系;
(4)根据Ksp[BaSO4]=c(Ba2+)· c(SO42-),可计算出需要放热c(Ba2+),进而计算最大浓度c(SO32-);据此分析解答问题。
(1)浓硫酸具有脱水性、吸水性和强氧化性,能使乙醇碳化“渐渐变黑”,故答案为:脱水性;
(2)①实验室用Cu与浓硫酸加热或者Na2SO3与浓硫酸发生氧化还原制取SO2,反应方程式为Na2SO3+H2SO4(浓)=Na2SO3+SO2↑+H2O或Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:Na2SO3+H2SO4(浓)=Na2SO3+SO2↑+H2O或Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Na2SO3+H2SO4(浓)=Na2SO3+SO2↑+H2O或Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
②乙根据现象Ⅲ认为生成了SO2和水,溴单质可以和二氧化硫、水发生氧化还原反应生成硫酸和溴化氢,故答案为:H2O;
③a、根据甲的设计,洗气瓶中盛放的试剂是氢氧化钠,可以和二氧化硫反应,吸收二氧化硫,排除二氧化硫的干扰,根据乙的设计,C中盛放的试剂是浓硫酸,具有吸水性,可以做干燥剂,根据乙的设计,即要证明干燥的二氧化硫不能使溴的四氯化碳褪色,但能使品红褪色,所以装置连接顺序为dcabef,故答案为:NaOH溶液;浓硫酸;dcabef;
b、证明SO2使E中溶液褪色的实验是加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2,故答案为:加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2;
c、溴单质可以和二氧化硫发生氧化还原反应,生成硫酸根离子和溴离子,硫酸根离子和钡离子反应会生成白色沉淀,相关反应的离子方程式为Br2+SO2+2H2O==4H++2Br-+SO42-、SO42-+Ba2+==BaSO4↓或Br2+SO2+2H2O+Ba2+=4H++2Br-+BaSO4↓,故答案为:Br2+SO2+2H2O==4H++2Br-+SO42-、SO42-+Ba2+==BaSO4↓或Br2+SO2+2H2O+Ba2+=4H++2Br-+BaSO4↓;
(3)根据图可以知道,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,则溶液中离子大小关系:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(4) 根据Ksp[BaSO4]=c(Ba2+)· c(SO42-),可知需要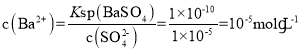 ,则溶液中SO32-的最大浓度
,则溶液中SO32-的最大浓度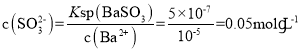 ,故答案为0.05。
,故答案为0.05。


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应包含氧化还原反应
D.反应②的化学方程式为2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据原电池原理,回答下列问题:

(1)图1是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料是________(填化学名称);电极Y的材料是__________(填化学名称)。
②Y电极发生的电极反应式为:______________。
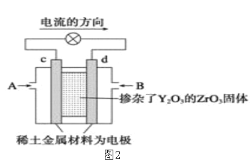
(2)图2是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e―→2O2-)。
①c电极为______________极。(填“正”或“负”)
②d电极上的电极反应式为___________________________。
③如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为______________(用NA表示),需要消耗标准状况下氧气的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某气体的摩尔质量为M g·mol-1,分子数目为N,质量是m g,阿伏加德罗常数为NA,m(C)为12C原子质量,试说明下列各式所表示的意义。
①![]() ________________________________。
________________________________。
②![]() _______________________________。
_______________________________。
③![]() ___________________________________。
___________________________________。
④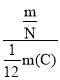 _____________________。
_____________________。
(2)下列气体在同温度、同体积、同质量时,压强最大的是(_______________)
A.CO2 B.CO C.CH4 D.H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁-锂双离子二次电池如图,下列关于该电池的说法不正确的是

A. 放电时,Li+由左向右移动
B. 放电时,正极的电极反应式为Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时,外加电源的正极与Y相连
D. 充电时,导线上每通过1mol e-,左室溶液质量减轻12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1 mL 0.1 mol·L-1 AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1 mol·L-1):

下列说法不正确的是
A. 实验①白色沉淀是难溶的AgCl B. 由实验②说明AgI比AgCl更难溶
C. 若按①③顺序实验,看不到黑色沉淀 D. 若按②①顺序实验,看不到白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)质量数为37的氯原子符号为_______。
(2)S2-的结构示意图为______。
(3)氮原子的电子式为______,N2的电子式为______,NH4+的电子式为_________
(4)磷原子的核外电子排布式为______,其价电子排布式为_____,其价电子排布图为_____。
(5)含有半满p轨道的最轻原子的核外电子排布式为_______,元素名称为_______;
(6)最活泼的非金属元素原子的核外电子排布式为_______,元素名称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198P—O:360O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为 ( )

A. -1638 kJ·mol-1B. +1638 kJ·mol-1C. -126 kJ·mol-1D. +126 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A.Mg2+的电子排布图: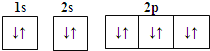
B.Na+的结构示意图:![]()
C.Cr的价层电子排布式:3d54s1
D.C的电子排布式:1s22s12p3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com