
【题目】按要求填空:
(1)质量数为37的氯原子符号为_______。
(2)S2-的结构示意图为______。
(3)氮原子的电子式为______,N2的电子式为______,NH4+的电子式为_________
(4)磷原子的核外电子排布式为______,其价电子排布式为_____,其价电子排布图为_____。
(5)含有半满p轨道的最轻原子的核外电子排布式为_______,元素名称为_______;
(6)最活泼的非金属元素原子的核外电子排布式为_______,元素名称为_______。
【答案】![]() Cl
Cl ![]()
![]()
![]()
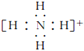 1s22s22p63s23p3 3s23p3
1s22s22p63s23p3 3s23p3 ![]() 1s2s22p3 氮 1s22s22p5 氟
1s2s22p3 氮 1s22s22p5 氟
【解析】
(1)元素符号左下角的数字为质子数,左上角的数字为质量数,质量数为37的氯原子符号为![]() Cl,故答案为:
Cl,故答案为:![]() Cl;
Cl;
(2)S2-的质子数为16,核外电子数为18,则硫离子结构示意图为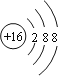 ,故答案为:
,故答案为: ;
;
(3)N原子最外层电子数为5,其电子式为![]() ,氮气中N原子均满足最外层8电子稳定结构,其电子式为
,氮气中N原子均满足最外层8电子稳定结构,其电子式为![]() ,铵根离子在含4个N-H键,其电子式为
,铵根离子在含4个N-H键,其电子式为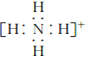 ,故答案为:
,故答案为:![]() ;
;![]() ;
;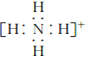 ;
;
(4)P的质子数为15,最外层电子数为5,则磷原子的核外电子排布式为1s22s22p63s23p3,其价电子排布式为3s23p3,其价电子排布图为![]() ,故答案为:1s22s22p63s23p3;3s23p3;
,故答案为:1s22s22p63s23p3;3s23p3;![]() ;
;
(5)含有半满p轨道的最轻原子,其最外层电子为2s22p3,原子序数为7,其电子排布式为:1s2s22p3,为氮元素,故答案为:1s2s22p3;氮;
(6)最活泼的非金属元素为F元素,电子排布式为1s22s22p5,故答案为:1s22s22p5;氟。


科目:高中化学 来源: 题型:
【题目】25℃时,起始浓度为0.1mol.L-1的亚硫酸溶液中,H2SO3、HSO3-、SO32-三种微粒的物质的量分数(即微粒本身物质的量与三种粒子总物质的量之比)随pH变化的关系如图所示。下列说法正确的是
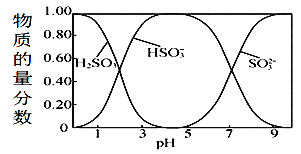
A.读取图中数据计算可得到常温下亚硫酸溶液的Ka2≈10-7
B.向该体系中加入一定量的NaOH固体,HSO3-的物质的量分数一定增大
C.在pH=1.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D.在该体系中的任意一点都存在:c2(H+)=c(H+)·c(HSO3-)+2c(H+)c(SO32-)+Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
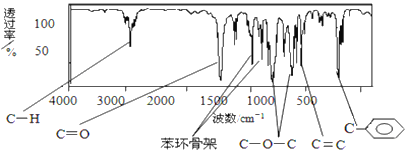
【题目】(1)肉桂酸甲酯由C、H、O三种元素组成,质谱分析其分子的相对分子质量为162,核磁共振氢谱谱图显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3 ,利用红外光谱仪检测其中的某些基团,测得红外光谱如图:则肉桂酸甲酯的结构简式是 _______(不考虑立体异构)。
(2)有机玻璃聚丙烯酸甲酯的结构简式为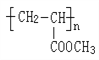 ,写出其单体____________;若聚合度n为3000,求有机玻璃的相对分子质量为________;
,写出其单体____________;若聚合度n为3000,求有机玻璃的相对分子质量为________;
(3)制备酚醛树脂的化学反应方程式:_________________________________;
(4)![]() 与足量NaOH溶液的反应方程式:
与足量NaOH溶液的反应方程式:
______________________________________________________________。
(5) 发生反应生成八元环状物质的反应方程式:
发生反应生成八元环状物质的反应方程式:
_______________________________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ.已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
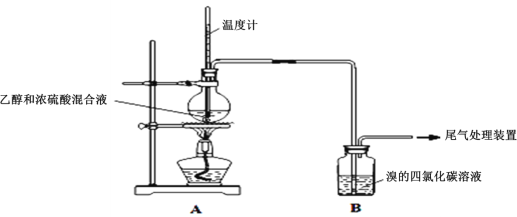
操作 | 现象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有___性。
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是___;
②乙根据现象认为实验中产生的SO2和___,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)
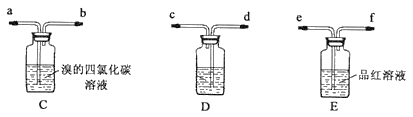
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是___;乙设计的实验D中盛放的试剂是___,装置连接顺序为___ (用仪器接口字母编号)。
b.能说明确实是SO2使E中溶液褪色的实验是___。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是___。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色。
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序___。
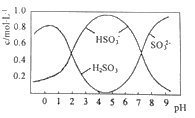
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )


A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应的应用比较广泛。阅读下面的材料,结合相关化学知识回答下列问题。黑火药主要是硝酸钾、硫磺、木炭三者粉末的混合物,在点燃条件下,其化学反应式主要为:2KNO3+S+3C=N2↑+3CO2↑+K2S
(1)在黑火药燃烧的反应中,氧化剂为___;
(2)该反应被氧化的元素是___;
(3)该反应的氧化产物是___;
(4)KNO3中N元素的化合价是___;
(5)根据化学反应式分析,一个硫原子参与反应时转移___个电子;
(6)把Cl2通入浓氨水中,发生如下反应:3Cl2+8NH3=6NH4Cl+N2。用双线桥表示反应的电子转移方向和数目:___。
(7)已知存在下列反应:①ClO3-+5Cl-+6H+ =3Cl2+3H2O ②2Fe2++Cl2=2Fe3++2 Cl-。则ClO3-、Fe3+、Cl2三种微粒氧化能力由强到弱的顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为短周期原子序数依次增大的主族元素,其原子序数之和为30,W与X、Y、Z都能形成共价化合物,Y、W形成的常见化合物溶于水显碱性,Z、W形成的化合物溶于水显酸性,四种元素形成的某种化合物的结构式为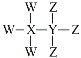 。下列说法错误的是
。下列说法错误的是
A.X为硼元素或碳元素
B.Y不属于第ⅣA族元素
C.W与Y、Z分别形成的常见化合物能反应生成盐
D.最高价氧化物对应的水化物的酸性:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288) 可由乳酸与FeCO3反应制得,它易溶于水,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁(装置如图所示)
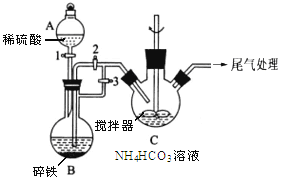
(1)仪器A的名称是______________ ;
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___________________________________________________________;然后关闭活塞1,接下来的操作是_______________; 装置C中发生反应的离子方程式为______________ 。
Ⅱ.制备乳酸亚铁
向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)为防止乳酸亚铁变质,在上述体系中还应加入____________________________________________________________________________
(4)为证明乳酸亚铁中含有Fe2+,选择的检验试剂为_______________________________________________________________________;
Ⅲ. 乳酸亚铁晶体纯度的测量
经过过滤、隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥等操作,获得乳酸亚铁晶体后
(5)两位同学分别用不同的方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是_________________________________________________________________________________________________________________
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+被还原为Ce3+),称取6.00g样品配成250.00mL溶液,取25mL,用0.1 molL—1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
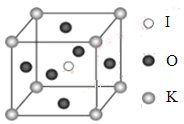
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com