
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应包含氧化还原反应
D.反应②的化学方程式为2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】(1)钠与氧气的反应会因条件不同而导致现象不同,产物不同,反应的实质也不同。据此回答下列问题:
①常温下,在空气中切开金属钠,钠的断面由银白色逐渐变暗而失去金属光泽,请用化学方程式解释这种现象产生的原因:__________________。
②钠在空气中受热所发生反应的化学方程式是__________________。
③将4.6克钠投入足量水中,标况下生成气体的体积是__________。
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为____________。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为___________________________________。
③实验室制备Al(OH)3的常用方法是向Al2(SO4)3溶液中逐滴滴加氨水至过量,请写出对应的化学方程式:___________________________________。
(3)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
①中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是_______。
②写出磁石的主要成分和盐酸反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱试样中含有 NaCl 杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
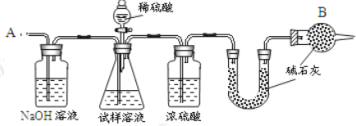
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将 a g 试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的 U 形管的质量,得到 b g;
④从分液漏斗滴入 6 molL-1的硫酸,直到不再产生气体时为止;
⑤从导管 A 处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的 U 型管的质量,得到 c g;
⑦重复步骤⑤和⑥的操作,直到 U 型管的质量基本不变,为 d g;
请填空和回答问题:
(1)第一个洗气瓶中氢氧化钠溶液的作用是____________________
(2)装置中干燥管 B 的作用是_______________________________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填偏高、偏低或不变)。
(4)步骤⑤的目的是_______________________________________
(5)步骤⑦的目的是_________________________________________
(6)该试样中纯碱的质量分数的计算式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准生成热指的是在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下 1mol 某纯物质的热效应,单位常用 kJ/mol表示,已知在 25℃的条件下:
①Ag2O(s)+2HCl(g)═2AgCl(s)+H2O(l)△H=-324.4 kJ/mol
②2Ag(s)+ ![]() O2(g)═Ag2O(s)△H=-30.56kJ/mol
O2(g)═Ag2O(s)△H=-30.56kJ/mol
③ ![]() H2(g)+
H2(g)+ ![]() Cl2(g)═HCl(g)△H=-92.21 kJ/mol
Cl2(g)═HCl(g)△H=-92.21 kJ/mol
④H2(g)+ ![]() O2(g)═H2O(l)△H=-285.6 kJ/mol
O2(g)═H2O(l)△H=-285.6 kJ/mol
则25℃时氯化银的标准生成热为________ kJ/mol;
(2)实验测得 64g 甲醇[CH3OH(l)]在氧气中充分燃烧生成 CO2 气体和液态水时放出 1452.8kJ 的热量,则表示甲醇燃烧热的热化学方程式_________________;
(3)以甲烷、氧气为原料,KOH 为电解质,构成燃料电池,写出其负极的电极反应式:________;
(4)电解法制取有广泛用途的 Na2FeO4,工作原理如下图所示。
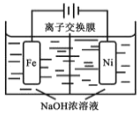
已知:Na2FeO4 只在强碱性条件下稳定。
①Na2FeO4能够净水的主要原因是_______________ 。
②阳极电极反应式 _______________;
③为使电解能较持久进行,应选用_______________ 离子交换膜(填“阴”或“阳”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.苯与苯乙烯具有相同最简式但不是同系物
B.乙醚和乙醇互为同分异构体
C.CH3—C≡C—CH=CH—![]() —CH3分子中最多可以有20个原子共平面
—CH3分子中最多可以有20个原子共平面
D.CH3CH2CH2CH3 和C(CH3)4互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.乙酸和甲醛分别完全燃烧,若消耗的氧气量一样,则它们的质量相等
B.通过核磁共振氢谱可以区分CH3 CH2CH2OH和![]()
C.莽草酸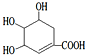 可以发生氧化、还原、酯化、加聚反应
可以发生氧化、还原、酯化、加聚反应
D.Cl2与甲苯在光照条件下反应,苯环上的氢原子被取代
查看答案和解析>>
科目:高中化学 来源: 题型:
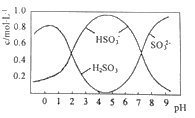
【题目】25℃时,起始浓度为0.1mol.L-1的亚硫酸溶液中,H2SO3、HSO3-、SO32-三种微粒的物质的量分数(即微粒本身物质的量与三种粒子总物质的量之比)随pH变化的关系如图所示。下列说法正确的是
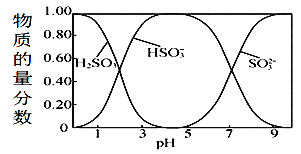
A.读取图中数据计算可得到常温下亚硫酸溶液的Ka2≈10-7
B.向该体系中加入一定量的NaOH固体,HSO3-的物质的量分数一定增大
C.在pH=1.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D.在该体系中的任意一点都存在:c2(H+)=c(H+)·c(HSO3-)+2c(H+)c(SO32-)+Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A.3g3He含有的中子数为NA
B.22gCO2与标准状况下11.2 L HF含有相同分子数
C.1 molK2Cr2O7被还原为Cr3+转移的电子数为6NA
D.在25℃、1.01×105 Pa的条件下,2.24LH2中含有的分子数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ.已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
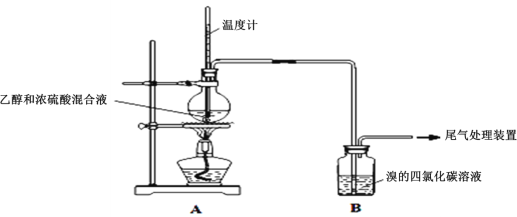
操作 | 现象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有___性。
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是___;
②乙根据现象认为实验中产生的SO2和___,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)
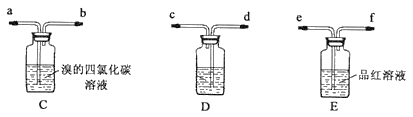
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是___;乙设计的实验D中盛放的试剂是___,装置连接顺序为___ (用仪器接口字母编号)。
b.能说明确实是SO2使E中溶液褪色的实验是___。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是___。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色。
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序___。
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤___mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com