
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图。根据图示转化关系回答:
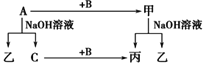
(1)写出下列物质的化学式。
A________,B________,甲_________,乙________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式________________________________。
②甲与NaOH溶液反应的离子方程式________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
【答案】Al O2 Al2O3 NaAlO2 2Al+2NaOH+2H2O===2 NaAlO2+3H2 ↑ Al2O3+2OH ===2AlO2-+H2O 0.1 mol 0.3 mol
【解析】
常见金属单质中能与NaOH溶液反应的只有Al,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,则A是Al、乙是NaAlO2、C是H2;铝的氧化物为两性氧化物,能与氢氧化钠溶液反应生成偏铝酸钠和水,由图示可知铝与B反应生成的化合物甲能与氢氧化钠溶液反应生成偏铝酸钠和丙,且氢气能与B反应生成丙,则甲是Al2O3、丙是H2O、B是O2。
(1)由上述分析可知,A为Al,B为O2,甲是Al2O3,乙是NaAlO2,故答案为:Al;O2;Al2O3;NaAlO2;
(2)①Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
②Al2O3与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
(3)标准状况下3.36 L氢气的物质的量为![]() ═0.15mol,根据铝与NaOH溶液反应的方程式可知消耗的Al的物质的量为0.15mol×
═0.15mol,根据铝与NaOH溶液反应的方程式可知消耗的Al的物质的量为0.15mol×![]() ==0.1mol,转移电子数目为0.1mol×3=0.3mol,故答案为:0.1mol,0.3 mol。
==0.1mol,转移电子数目为0.1mol×3=0.3mol,故答案为:0.1mol,0.3 mol。


科目:高中化学 来源: 题型:
【题目】图为几种化合物的元素组成示意图,以下说法错误的是

A. 若①为某种具有催化作用的化合物,则其水解产物为氨基酸
B. 若②为脂肪,则其大量积累于皮下和内脏器官周围
C. 若③为蓝藻的遗传物质,则其和蛋白质组成染色体
D. 若④为糖原,则其主要分布在人和动物的肌肉和肝脏中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种无色可溶性盐分别是由Na+、Ag+、NO3-、CO32-中不同的阴、阳离子所组成。经实验A溶液、B溶液均可与盐酸反应,其中A产生白色沉淀,B产生气泡,则:
(1)A为_____________,B为_____________;
(2)A与适量KCl恰好完全反应的离子方程式:_______________________________ ,
过滤后滤液中的溶质可能的用途_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol Na2O2固体中含离子的总数为4NA
B.Na2O2与H2O反应生成1.12 L O2(标准状况),反应中转移的电子数为0.2NA
C.1 mol氧气与钠反应,转移的电子数为一定为4NA
D.将1 mol甲醇(CH4O)完全燃烧生成的CO2和水蒸气通过足量的Na2O2固体,充分反应后固体增重32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物的种类很多,我们可以按照“金属单质、金属氧化物、金属氢氧化物、盐”的类别进行研究。以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成)。
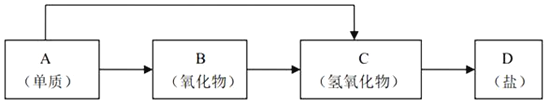
(1)若B为呼吸面具中的供氧剂,其供氧时每生成1molO2,反应过程中转移的电子数为___________________,A与水反应的离子方程式为:_____________________。
(2)200℃时,11.6g CO2和H2O的混合物气体与足量的B反应,反应后固体增加了3.6g,则原混合物的平均相对分子质量为______________。
(3)写出一种“C→D”转化的离子方程式:___________________________________。
(4)某同学将一小块A单质露置于空气中,观察到下列现象:
银白色![]() 变灰暗
变灰暗![]() 变白色
变白色![]() 出现液滴
出现液滴![]() 白色固体
白色固体
则下列说法正确的是_____________________。
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是____________。
②氨催化氧化生成一氧化氮反应的化学方程式是___________。
(2)氨的定量检测。水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
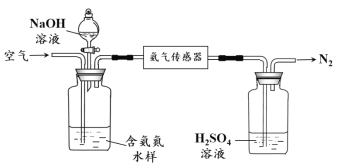
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_______________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol,则水样中氨氮(以氨气计)含量为________mg·L-1。
(3)氨的转化与去除。 微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
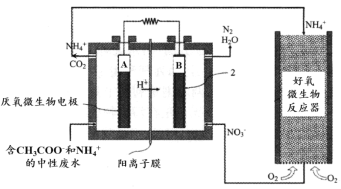
已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习的本质在于,让学生亲历知识产生与形成的过程。我校某化学研究性学习小组欲以CO2为主要原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究.
【资料获悉】“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3灼烧制成Na2CO3.
【实验设计】如图1所示

【实验探究】
(1)装置乙的作用是 .
(2)若在NaHCO3灼烧中时间较短,NaHCO3将分解不完全.取经短暂加热的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示.则曲线b对应的溶液中的离子是 (填离子符号);该样品中Na2CO3和NaHCO3的物质的量之比是 。
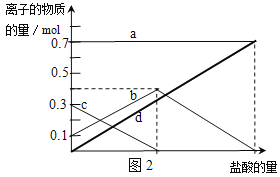
(3)若将装置甲产生的纯净的CO21.68L(标准状况下)缓慢地全部通入到100mL NaOH溶液中,充分反应后,将溶液低温蒸干,得到不含结晶水的固体W,其质量为7.4g,则W的成分为 (填化学式),原NaOH溶液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验一:
如图所示为实验室制取蒸馏水的装置示意图。

根据图示回答下列问题:
图中两处明显错误是:
①________; ②________。
(2)A仪器的名称是________, B仪器的名称是________。
(3)实验时,A中除加入少量自来水外,还需要加入少量的________,其作用是________。
(4)实验二:
碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4,该小组先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,转移到分液漏斗中,再加入一定量的苯,振荡。分液漏斗使用前应先________,振荡后上层液体为________(填有机层、水层)。
(5)萃取碘水中的I2单质时要用到萃取剂,下列关于所加萃取剂的说法正确的是______
A.不与碘反应
B.碘在其中的溶解度远大于在水中的溶解度
C.该萃取剂与水不互溶且密度比水大
D.可以选用CCl4、酒精做萃取剂
(6)某学生在一次分液操作中发现上下层溶液都是无色液体,无法知道分液漏斗中的液体哪一层是有机层,哪一层是水层,请你用简单的方法帮他鉴别出来,写出有关步骤及判断方法________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
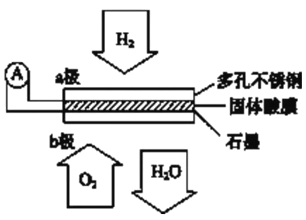
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e--=4OH--
C. 每转移0.1mol电子,消耗1.12L的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com