
【题目】A、B两种无色可溶性盐分别是由Na+、Ag+、NO3-、CO32-中不同的阴、阳离子所组成。经实验A溶液、B溶液均可与盐酸反应,其中A产生白色沉淀,B产生气泡,则:
(1)A为_____________,B为_____________;
(2)A与适量KCl恰好完全反应的离子方程式:_______________________________ ,
过滤后滤液中的溶质可能的用途_____________。
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

已知:
①2KOH+Cl2===KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2===5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+3KClO+10KOH===2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)该生产工艺应在______________(填“温度较高”或“温度较低”)情况下进行,从绿色化学的角度考虑通入氯气速率应________(填“较快”或“较慢”);
(2)写出工业上制取Cl2的化学方程式_____________;
(3)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K2FeO4)进行消毒、净化以改善水质,其原因是______
(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为____________(保留整数);
(5)在“反应液I”中加KOH固体的目的是__________:
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间在相应条件下转化均能一步实现的是( )
A.SiO2![]() H2SiO3
H2SiO3![]() Na2SiO3(aq)
Na2SiO3(aq)
B.Ca(OH)2![]() Ca(ClO)2
Ca(ClO)2![]() HClO
HClO
C.MgCl26H2O![]() MgCl2
MgCl2![]() Mg
Mg
D.N2![]() NO2
NO2 ![]() HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电极上每通过96 500 C的电量就会有1 mol电子发生转移。精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量。实际测量中,常用银电量计,如图所示。下列说法不正确的是

A. 电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应是:Ag++ e-=" Ag"
B. 称量电解前后铂坩埚的质量变化,得金属银的沉积量为108.0 mg,则电解过程中通过电解池的电量为96.5 C
C. 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋。若没有收集网袋,测量结果会偏高。
D. 若要测定电解饱和食盐水时通过的电量,可将该银电量计中的银棒与待测电解池的阳极相连,铂坩埚与电源的负极相连。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.65g的锌加到50mL 1mol/L 盐酸中发生如下反应:Zn+2HCl=ZnCl2+H2↑,生成0.224L的H2(标准状况下),则:
(1)填空:0.65g的锌的物质的量___________,生成的0.224L的氢气的物质的量___________,反应前盐酸的物质的量___________,实际参加反应的盐酸的物质的量___________,
(2)计算:若反应完成后体积不变,溶液中剩余盐酸的物质的量浓度_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A. 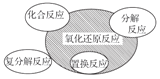 四种基本反应类型与氧化还原反应的关系
四种基本反应类型与氧化还原反应的关系
B.  AlCl3溶液中滴加NaOH溶液生成沉淀的情况
AlCl3溶液中滴加NaOH溶液生成沉淀的情况
C.  Ba(OH)2溶液中滴加硫酸溶液导电性的情况
Ba(OH)2溶液中滴加硫酸溶液导电性的情况
D.  等体积、等浓度稀硫酸分别与足量铁和镁反应的情况
等体积、等浓度稀硫酸分别与足量铁和镁反应的情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )
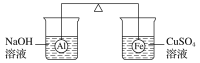
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图。根据图示转化关系回答:
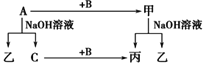
(1)写出下列物质的化学式。
A________,B________,甲_________,乙________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式________________________________。
②甲与NaOH溶液反应的离子方程式________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表示可逆反应A(s)+B(g) n C(g);ΔH=Q kJ·mol1,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的
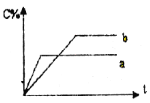
A. 若条件为催化剂,则a表示有催化剂,b表示没有催化剂
B. 只改变温度,则a比b的温度高,且Q>0
C. 只改变压强,则a比b的压强大,n>2
D. 由图象可以作出判断,反应一定从正反应方向开始
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com