
【题目】已知电极上每通过96 500 C的电量就会有1 mol电子发生转移。精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量。实际测量中,常用银电量计,如图所示。下列说法不正确的是

A. 电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应是:Ag++ e-=" Ag"
B. 称量电解前后铂坩埚的质量变化,得金属银的沉积量为108.0 mg,则电解过程中通过电解池的电量为96.5 C
C. 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋。若没有收集网袋,测量结果会偏高。
D. 若要测定电解饱和食盐水时通过的电量,可将该银电量计中的银棒与待测电解池的阳极相连,铂坩埚与电源的负极相连。
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列描述,不正确的是
A. 正戊烷、异戊烷、新戊烷的沸点依次降低
B. 相对分子质量为104的烃,分子中不可能只存在单键
C. 光照下2,2一二甲基丙烷与Br2反应其二溴取代物有两种
D. FeCl3溶液可以把4种无色溶液:乙醇、苯酚、AgNO3溶液、KOH溶液一一区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为几种化合物的元素组成示意图,以下说法错误的是

A. 若①为某种具有催化作用的化合物,则其水解产物为氨基酸
B. 若②为脂肪,则其大量积累于皮下和内脏器官周围
C. 若③为蓝藻的遗传物质,则其和蛋白质组成染色体
D. 若④为糖原,则其主要分布在人和动物的肌肉和肝脏中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
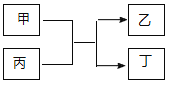
A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图,据图推断错误的是
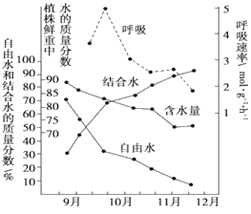
A. 结合水与自由水含量的比值,与小麦的抗寒性呈正相关
B. 总含水量下降是因为细胞呼吸增强,需要消耗更多的水
C. 随着气温和土壤温度的下降,小麦的含水量下降
D. 11月时,小麦细胞中含量最多的化合物仍是水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)如下图装置实验,A、B两烧杯分别盛放200 g10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5 g(不考虑水的蒸发)。
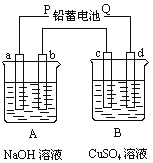
请回答下列问题:
(1)电源P极为 极;请分别写出b极和c极上发生的电极反应 式: ;
(2)c极上析出固体铜的质量为 g
(3)若装置中用铅蓄电池作电源,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42 -=PbSO4+2e-
正极:PbO2+4H++SO42 -+2e-=PbSO4+2H2O
假设在a极制得气体0.050 mol,这时电池内消耗的H2SO4的物质的量至少是 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种无色可溶性盐分别是由Na+、Ag+、NO3-、CO32-中不同的阴、阳离子所组成。经实验A溶液、B溶液均可与盐酸反应,其中A产生白色沉淀,B产生气泡,则:
(1)A为_____________,B为_____________;
(2)A与适量KCl恰好完全反应的离子方程式:_______________________________ ,
过滤后滤液中的溶质可能的用途_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol Na2O2固体中含离子的总数为4NA
B.Na2O2与H2O反应生成1.12 L O2(标准状况),反应中转移的电子数为0.2NA
C.1 mol氧气与钠反应,转移的电子数为一定为4NA
D.将1 mol甲醇(CH4O)完全燃烧生成的CO2和水蒸气通过足量的Na2O2固体,充分反应后固体增重32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验一:
如图所示为实验室制取蒸馏水的装置示意图。

根据图示回答下列问题:
图中两处明显错误是:
①________; ②________。
(2)A仪器的名称是________, B仪器的名称是________。
(3)实验时,A中除加入少量自来水外,还需要加入少量的________,其作用是________。
(4)实验二:
碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4,该小组先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,转移到分液漏斗中,再加入一定量的苯,振荡。分液漏斗使用前应先________,振荡后上层液体为________(填有机层、水层)。
(5)萃取碘水中的I2单质时要用到萃取剂,下列关于所加萃取剂的说法正确的是______
A.不与碘反应
B.碘在其中的溶解度远大于在水中的溶解度
C.该萃取剂与水不互溶且密度比水大
D.可以选用CCl4、酒精做萃取剂
(6)某学生在一次分液操作中发现上下层溶液都是无色液体,无法知道分液漏斗中的液体哪一层是有机层,哪一层是水层,请你用简单的方法帮他鉴别出来,写出有关步骤及判断方法________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com