
| ���� | ��ѧʽ | ��ɫ��״̬ | �ܽ�ȣ�g�� | �۵㣨�棩 | �ܶȣ�g/cm3�� |
| �Ҷ��� | H2C2O4 | �D | 8.6��20�棩 | 189.5 | 1.900 |
| ��ˮ���Ҷ��� | H2C22?2H2O | ��ɫ���� | �D | 101.5 | 1.650 |
ע���Ҷ��ᣨHOOC�DCOOH���׳Ʋ��ᣬ��2���ᾧˮ���Ҷ����׳Ʋ��ᾧ�壬���ᾧ��ʧȥ�ᾧˮ����ˮ���ᣬ��Լ157��ʱ���������β���ƺͲ�����ƾ�Ϊ��ɫ�����
����������Ϣ���ش��������⡣
��1����ʢ��Na2CO3��ĩ���Թ������Լ3mL�Ҷ�����Һ���۲쵽�������� ��˵���Ҷ�������Ա�̼�� ���ǿ������������
��2����ʢ��5mL�Ҷ��ᱥ����Һ���Թ��е���3���������ữ��0.5%�������������ĸ��������Һ�����۲쵽������Ϊ _______ ��˵���Ҷ�����_____ �ԡ�
��3����A�Թ��м���3mL�Ҷ��ᣬȻ������Թܱ���2mLŨ�����2mL�Ҷ��ᣬ����ͼ�����Ӻ�װ�ã�����3 -5min����B��������״�Ҵ�����ζ��Һ�������������˵�������� ��Ӧ�����л���Ӧ���ͣ�����B�Թ��м��뱥�� Na2CO3��Һ��Ŀ���� ��
B�е��ܿ���Һ���ϵ�ԭ���� ��
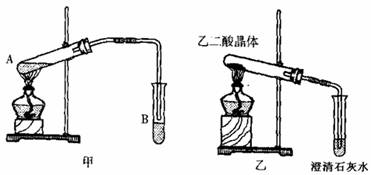
��4����֪����ֽ�Ļ�ѧ����ʽΪ��H2C2O4 ![]() H2O+CO2��+CO������ͼ��װ�ü��Ȳ��ᾧ�壬��֤�������ȷֽ⼰������������Ϊ��װ�ò�������������������Ϣ��ʵ��Ŀ�ģ�����������ԭ�� �������������ѡ��
H2O+CO2��+CO������ͼ��װ�ü��Ȳ��ᾧ�壬��֤�������ȷֽ⼰������������Ϊ��װ�ò�������������������Ϣ��ʵ��Ŀ�ģ�����������ԭ�� �������������ѡ��
a�����ᾧ����۵�ϵͣ�δ�ֽ�֮ǰ�����ڻ��������Թܿڣ������ڻ�ѧ��Ӧ�Ľ��м�ʵ������Ĺ۲졣
b����Ϊ�����Dz��ᾧ�壬���Ը�װ�����ֻ�ܼ���һ�ַֽ������ܼ����Ƿ�
���������ֽ���
c����δϴ���������ͨ��ʯ��ˮ�������������������ʯ��ˮ��Ӧ���ɲ���Ƴ�������ʵ���и��š�
��5����װ��Ҳ��������ɫ��ѧ��Ҫ����˵��ԭ�� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | ��ѧʽ | ��H/��kJ?mol-1�� |
| һ����̼ | CO��g�� | -283.0 |
| ��ϩ | C2H4��g�� | -1411.0 |
| �Ҵ� | C2H5OH��l�� | -1366.8 |
| A��-44.2 kJ?mol-1 |
| B��+44.2 kJ?mol-1 |
| C��-330 kJ?mol-1 |
| D��+330 kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������ϡ�
�����ij���������
���� | ��ѧʽ | ɫ��̬ | ��Ԫ�ص��������� |
�������� | FeO | ��ɫ��ĩ | w(Fe)=77.8% |
������ | Fe2O3 | ����ɫ��ĩ(�׳�����) | w(Fe)=70.0% |
���������� | Fe3O4 | ��ɫ����(�׳ƴ���������) | w(Fe)=72.4% |
�ڲ���(�Ҷ���H2C2O4)��Ũ������������ȷֽ�Ļ�ѧ����ʽΪH2C2O4![]() CO2��+ CO��+H2O
CO2��+ CO��+H2O
��ʵ������
��ʵ���װ��ͼ����

��ҩƷ
a.���� b.��ҵ���� c.NaOH��Һ d.����ʯ��ˮ e.Ũ���� f.����
��ʵ�鼰���ݡ�
ȡ��ͬ��������Ʒ����ʵ�飬����ʵ���������£�
ʵ����� | ��Ʒ����/g | ������������/g |
1 | 4.00 | 2.91 |
2 | 8.00 | 7.00 |
3 | 10.00 | 7.27 |
4 | 12.00 | 8.72 |
5 | 14.00 | 10.18 |
6 | 16.00 | 11.63 |
�������������
(1)��ȤС���ͬѧ���Դ�����CO��ԭ�������������Ƶ�ʵ��װ����D��E��FӦ�ֱ�ʢ�ŵ��Լ�Ϊ____________��____________��___________(��д���)��������������____________��____________��_____________������װ�û��в�����֮�����㽨��Ľ��Ĵ�ʩ��________________________��
(2)��ʵ�����ݲ��ѵó�����һ��ʵ�����ݲ��ɿ�������������____________(�����)���ù�ҵ�����������ʵĻ�ѧʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
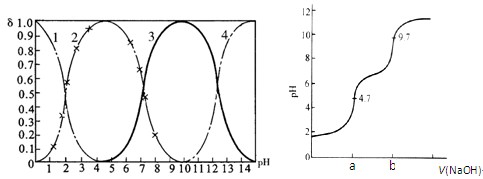
��14�֣����ᣨH3PO4����ˮ�пɷ��������룬�ܹ���H3PO4��H2PO�� 4��HPO2�� 4��PO3�� 4������������ʽ���ڣ�����Һ��pH�����仯ʱ��������һ���ӵ����ʵ���ռ�������������ʵ����ķ����ģ��ֲ�������Ҳ���ܷ����仯��ͼ1��ijŨ��H3PO4��Һ�и������ӵ����ʵ�����������pH�ı仯���ߡ���NaOH����Һ�ζ���H3PO4��Һ����õζ�������ͼ2��
ͼ1 H3PO4���ӷֲ�������pH��ϵ ͼ2 H3PO4�ζ����ߣ����֣�
����ע��ͼ������1��ʾH3PO4������2��ʾH2PO�� 4������3��ʾHPO2�� 4������4��ʾPO3�� 4��
��1��H3PO4��һ������ĵ��볣��K1�ı���ʽΪ_______��K1����ֵ��ӽ�������ĸ��______��
A��10��2.1 ������B��10��4.7 ������C��10��7 ������D��10��9.7
��2����NaOH�ζ�H3PO4��д����Ӧ��a�㵽b������ӷ���ʽ____________________�����ζ���pH��7ʱ����Һ��Ҫ���ڵ������ӣ�OH�����⣩��_______________��
��3����Na3PO4��Һ�У�![]() ____3���>������<������=������ԭ����__________________�������ӷ���ʽ��ʾ����
____3���>������<������=������ԭ����__________________�������ӷ���ʽ��ʾ����
��4������ơ�����һ��ƺ�����������������Ҫ�������Σ���ʳƷ�����ʵȷ���Ӧ�ù㷺����20��ʱ�ܽ���������±���
| ���� | ��ѧʽ | 20��ʱ�ܽ�ȣ�g�� |
| ����� | Ca3(PO4)2 | 2��10��3 |
| ����һ��� | CaHPO4 | 4.3��10��3 |
| �������� | Ca(H2PO4)2 | 1.8 |
�������ˮ���ܽ�Ⱥ�С����������ϡ���ᡣ���ƽ���ƶ�ԭ��������ԭ��
_________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��㶫ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��� ���ͣ������
��14�֣����ᣨH3PO4����ˮ�пɷ��������룬�ܹ���H3PO4��H2PO�� 4��HPO2�� 4��PO3�� 4������������ʽ���ڣ�����Һ��pH�����仯ʱ��������һ���ӵ����ʵ���ռ�������������ʵ����ķ����ģ��ֲ�������Ҳ���ܷ����仯��ͼ1��ijŨ��H3PO4��Һ�и������ӵ����ʵ�����������pH�ı仯���ߡ���NaOH����Һ�ζ���H3PO4��Һ����õζ�������ͼ2��

ͼ1 H3PO4���ӷֲ�������pH��ϵ ͼ2 H3PO4�ζ����ߣ����֣�
����ע��ͼ������1��ʾH3PO4������2��ʾH2PO�� 4������3��ʾHPO2�� 4������4��ʾPO3�� 4��
��1��H3PO4��һ������ĵ��볣��K1�ı���ʽΪ_______��K1����ֵ��ӽ�������ĸ��______��
A��10��2.1 ������B��10��4.7 ������C��10��7 ������D��10��9.7
��2����NaOH�ζ�H3PO4��д����Ӧ��a�㵽b������ӷ���ʽ____________________�����ζ���pH��7ʱ����Һ��Ҫ���ڵ������ӣ�OH�����⣩��_______________��
��3����Na3PO4��Һ�У� ____3���>������<������=������ԭ����__________________�������ӷ���ʽ��ʾ����
____3���>������<������=������ԭ����__________________�������ӷ���ʽ��ʾ����
��4������ơ�����һ��ƺ�����������������Ҫ�������Σ���ʳƷ�����ʵȷ���Ӧ�ù㷺����20��ʱ�ܽ���������±���
|
���� |
��ѧʽ |
20��ʱ�ܽ�ȣ�g�� |
|
����� |
Ca3(PO4)2 |
2��10��3 |
|
����һ��� |
CaHPO4 |
4.3��10��3 |
|
�������� |
Ca(H2PO4)2 |
1.8 |
�������ˮ���ܽ�Ⱥ�С����������ϡ���ᡣ���ƽ���ƶ�ԭ��������ԭ��
_________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ᣨH3PO4����ˮ�пɷ��������룬�ܹ���H3PO4��H2PO�� 4��HPO2�� 4��PO3�� 4������������ʽ���ڣ�����Һ��pH�����仯ʱ��������һ���ӵ����ʵ���ռ�������������ʵ����ķ����ģ��ֲ�������Ҳ���ܷ����仯��ͼ1��ijŨ��H3PO4��Һ�и������ӵ����ʵ�����������pH�ı仯���ߡ���NaOH����Һ�ζ���H3PO4��Һ����õζ�������ͼ2��
ͼ1 H3PO4���ӷֲ�������pH��ϵ ͼ2 H3PO4�ζ����ߣ����֣�
����ע��ͼ������1��ʾH3PO4������2��ʾH2PO�� 4������3��ʾHPO2�� 4������4��ʾPO3�� 4��
��1��H3PO4��һ������ĵ��볣��K1�ı���ʽΪ_______��K1����ֵ��ӽ�������ĸ��______��
A��10��2.1 ������B��10��4.7 ������C��10��7 ������D��10��9.7
��2����NaOH�ζ�H3PO4��д����Ӧ��a�㵽b������ӷ���ʽ____________________�����ζ���pH��7ʱ����Һ��Ҫ���ڵ������ӣ�OH�����⣩��_______________��
��3����Na3PO4��Һ�У�![]() ____3���>������<������=������ԭ����__________________�������ӷ���ʽ��ʾ����
____3���>������<������=������ԭ����__________________�������ӷ���ʽ��ʾ����
��4������ơ�����һ��ƺ�����������������Ҫ�������Σ���ʳƷ�����ʵȷ���Ӧ�ù㷺����20��ʱ�ܽ���������±���
| ���� | ��ѧʽ | 20��ʱ�ܽ�ȣ�g�� |
| ����� | Ca3(PO4)2 | 2��10��3 |
| ����һ��� | CaHPO4 | 4.3��10��3 |
| �������� | Ca(H2PO4)2 | 1.8 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com