
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。

(1)写出该反应的化学方程式 ,其中氧化剂是 ,还原剂是 。8.4g铁粉参加反应,转移电子 mol。
(2)玻璃管中石棉绒的作用是 ,实验开始时应先点燃 ,实验结束时应先熄灭 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶里应事先放置 ,其作用是 。
(4)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是 ,若溶液未变红色则说明硬质试管中固体物质的成分是 。
(5)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是 (用离子方程式表示)。
(6)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式 , 。

(7)一段时间后,该同学发现(4)中未变红的溶液变成红色,说明Fe2+ 具有 性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是 ,并且配制含Fe2+的盐溶液时应加入少量 。
(1)3Fe+4H2O(g) Fe3O4+4H2,Fe,H2O,0.4;(2)铁粉的载体,增大铁粉和水蒸气的接触面积。酒精灯,酒精喷灯;(3)为实验提供水蒸气,碎瓷片,防止暴沸;(4)一定有Fe3O4可能有Fe,Fe3O4、Fe;(5)Fe+2Fe3+=3Fe2+;(6)FeSO4+2NaOH=Fe(OH)3↓+Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3;(7)还原,Fe2+易被空气中的氧气氧化而变质,铁粉。
Fe3O4+4H2,Fe,H2O,0.4;(2)铁粉的载体,增大铁粉和水蒸气的接触面积。酒精灯,酒精喷灯;(3)为实验提供水蒸气,碎瓷片,防止暴沸;(4)一定有Fe3O4可能有Fe,Fe3O4、Fe;(5)Fe+2Fe3+=3Fe2+;(6)FeSO4+2NaOH=Fe(OH)3↓+Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3;(7)还原,Fe2+易被空气中的氧气氧化而变质,铁粉。
【解析】
试题分析:(1)Fe和H2O(g)受热时反应生成四氧化三铁和氢气,根据反应前后原子个数守恒配平,反应:3Fe+4H2O(g) Fe3O4+4H2,在反应中Fe由0→+
Fe3O4+4H2,在反应中Fe由0→+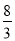 ,化合价升高被氧化,是还原剂,H2O由+1→0,化合价降低被还原,是氧化剂,3molFe参加反应共转移了8mole-,8.4g(0.15mol)Fe参加反应转移电子数
,化合价升高被氧化,是还原剂,H2O由+1→0,化合价降低被还原,是氧化剂,3molFe参加反应共转移了8mole-,8.4g(0.15mol)Fe参加反应转移电子数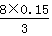 =0.4mol;(2)石棉绒是铁的载体,增大铁粉和水蒸气的接触面积,加快反应速率和提高原料利用率。实验开始时先点燃酒精灯,让水蒸气排除装置中的空气,防止反应过程中产生的氢气与氧气混合发生危险,实验结束时先熄灭酒精喷灯,防止生成的Fe3O4与产生H2发生置换反应;(3)铁和水蒸气反应,实验室不贮存气体需要制取,该装置的作用是“提供水蒸气”,加热液体为防止暴沸,需要加入碎瓷片或沸石,填写“碎瓷片或沸石,作用防止暴沸”;(4)滴加KSCN溶液,若溶液变红,说明溶液中有Fe3+,而Fe3O4中铁的价态有+2、+3,固体物质肯定含有Fe3O4,可能有Fe,如果溶液不变红,溶液中没有Fe3+,固体物质一定有Fe3O4、Fe,因为Fe3O4+8H+=Fe2++2Fe3++4H20,Fe+2Fe3+=3Fe2+,溶液滴加KSCN不变红;(5)溶液不变红说明没有Fe3+,Fe4O3+8H+=Fe2++2Fe3++4H2O,Fe具有还原性,Fe3+具有强氧化性,有中间价态,反应:Fe+2Fe3+=3Fe2+;(6)白色沉淀迅速变成灰绿色,最后变成红褐色,说明白色沉淀是Fe(OH)2,溶液B中有Fe2+,Fe(OH)2具有强还原性,能被空气中的氧气氧化成Fe(OH)3,发生的反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3;(7)Fe2+既具有氧化性又具有还原性,以还原性为主,过一段时间后,溶液变红,说明溶液中有Fe3+,化合价升高,原因是空气中氧气把Fe2+氧化成了Fe3+,Fe2+具有还原性;Fe2+的盐溶液现用现配的原因是因为Fe2+容易被氧气氧化成Fe3+而变质;保存Fe2+的盐溶液时往往加入少量的铁粉,防止Fe2+被氧化。
=0.4mol;(2)石棉绒是铁的载体,增大铁粉和水蒸气的接触面积,加快反应速率和提高原料利用率。实验开始时先点燃酒精灯,让水蒸气排除装置中的空气,防止反应过程中产生的氢气与氧气混合发生危险,实验结束时先熄灭酒精喷灯,防止生成的Fe3O4与产生H2发生置换反应;(3)铁和水蒸气反应,实验室不贮存气体需要制取,该装置的作用是“提供水蒸气”,加热液体为防止暴沸,需要加入碎瓷片或沸石,填写“碎瓷片或沸石,作用防止暴沸”;(4)滴加KSCN溶液,若溶液变红,说明溶液中有Fe3+,而Fe3O4中铁的价态有+2、+3,固体物质肯定含有Fe3O4,可能有Fe,如果溶液不变红,溶液中没有Fe3+,固体物质一定有Fe3O4、Fe,因为Fe3O4+8H+=Fe2++2Fe3++4H20,Fe+2Fe3+=3Fe2+,溶液滴加KSCN不变红;(5)溶液不变红说明没有Fe3+,Fe4O3+8H+=Fe2++2Fe3++4H2O,Fe具有还原性,Fe3+具有强氧化性,有中间价态,反应:Fe+2Fe3+=3Fe2+;(6)白色沉淀迅速变成灰绿色,最后变成红褐色,说明白色沉淀是Fe(OH)2,溶液B中有Fe2+,Fe(OH)2具有强还原性,能被空气中的氧气氧化成Fe(OH)3,发生的反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3;(7)Fe2+既具有氧化性又具有还原性,以还原性为主,过一段时间后,溶液变红,说明溶液中有Fe3+,化合价升高,原因是空气中氧气把Fe2+氧化成了Fe3+,Fe2+具有还原性;Fe2+的盐溶液现用现配的原因是因为Fe2+容易被氧气氧化成Fe3+而变质;保存Fe2+的盐溶液时往往加入少量的铁粉,防止Fe2+被氧化。
考点:考查铁与水蒸气反应实验的基本操作、铁及其化合物的性质等相关知识。
考点分析: 考点1:综合性实验 考点2:铁及其化合物 考点3:铜及其化合物 试题属性

 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源:2014-2015山西省忻州市高一上学期期末考试化学试卷(解析版) 题型:填空题
(共9分)现有下列四组物质
A、CaO、MgO、CO2、CuO B、H2、Cl2、N2、Cu
C、O2、 Fe、Cu、 Zn D、HCl、H2O、H2SO4、HNO3
(1)请填写下表:
A组 | B组 | C组 | D组 | |
分类标准 | 金属氧化物 | 金属单质 | ||
不属于该类别的物质 | Cu | H2O |
(2)已知(1)中涉及到的不属于该类别的四种物质间相互作用可生成一种新物质——碱式碳酸铜[化学式:Cu2(OH)2CO3]。
①生成碱式碳酸铜的化学方程式是__________________________________,此反应______(填“是”或“不是”)氧化—还原反应。
②碱式碳酸铜与D组中的类别物质反应的离子方程式是__________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省校高一上学期期末考试化学试卷(解析版) 题型:选择题
下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是
A. Cu(OH)2+HCl;CuO+HCl B. K2CO3+H2SO4;Na2CO3+HCl
C. NaHCO3+NaOH;KHCO3+HCl D. BaCl2+H2SO4;Ba(OH)2+H2SO4
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:选择题
某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如右图所示的装置进行实验,过一段时间后观察。下列现象可能出现的是

A.B中导气管中产生气泡 B.B中导气管里形成一段水柱
C.锥形瓶中溶液无色 D.铁被腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省青岛平度市三校高二上学期期末考试化学试卷(解析版) 题型:选择题
下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g) = 2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8KJ/mol
B.已知4P(红磷,s)= P4(白磷,s);△H>0,则白磷比红磷稳定
C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(ag)+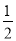 H2SO4(ag)=
H2SO4(ag)= 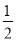 Na2SO4(ag)+H2O(l);△H=-57.4kJ/mol
Na2SO4(ag)+H2O(l);△H=-57.4kJ/mol
D.己知C(s)+ O2(g)= CO2(g);△H1 C(s)+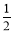 O2(g)= CO(g);△H2 则△H1>△H2
O2(g)= CO(g);△H2 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源:2014-2015内蒙古赤峰市宁城县高一上学期期末考试化学试卷(解析版) 题型:选择题
准确称取6.0 g铝土矿样品(含Fe2O3),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为
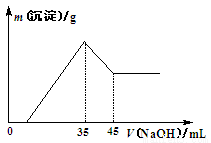
A.1.75 mol·L-1
B.3.50 mol·L-1
C.0.85 mol·L-1
D.无法确定
查看答案和解析>>
科目:高中化学 来源:2014-2015内蒙古赤峰市宁城县高一上学期期末考试化学试卷(解析版) 题型:选择题
在无色透明的溶液中可以大量共存的离子组是
A.H+、K+、HCO3-、NO3- B.OH-、Cl-、Na+、NH4+
C.Cu2+、NO3-、OH-、Cl- D.Mg2+、K+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015内蒙古赤峰市宁城县高二上学期期末考试化学试卷(解析版) 题型:选择题
香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A.常温下,1mol丁香酚只能与1molBr2反应
B.丁香酚不能使FeCl3溶液发生显色反应
C.1mol香兰素最多能与3mol氢气发生加成反应
D.香兰素分子中至少有12个原子共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com