
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为 0.20mol·L-1的 MgCl2 和 CaCl2 混合溶液中逐滴加入 Na3PO4,先生成沉淀________(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c________。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
①毒重石用盐酸浸取前需充分研磨,目的是________。
②加入NH3·H2O调节pH=8 可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________。
【答案】 Mg3(PO4)2 <10-4mol·L-1 可以增大反应物的接触面积,增大反应速率 Fe3+ Mg(OH)2、Ca(OH)2 会导致生成BaC2O4沉淀,产品产量会减少
【解析】(1)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Mg3(PO4)2先生成沉淀,当溶液中c(Mg2+)<10-5 mol/L时,认为镁离子完全沉淀,则溶液中的磷酸根浓度为c2(PO43-)>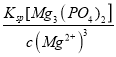 =
=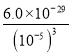 =6.0×10-14 mol2·L-2,所以c(Ca2+)<
=6.0×10-14 mol2·L-2,所以c(Ca2+)<![]() =10-4 mol·L-1,故答案为:Mg3(PO4)2;<10-4 mol·L-1;
=10-4 mol·L-1,故答案为:Mg3(PO4)2;<10-4 mol·L-1;
(2)制备BaCl22H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣1为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4↓,除去Ca2+,蒸发浓缩冷却结晶得到BaCl22H2O。
①化学反应的速率与反应物的接触面积有关,毒重石用盐酸浸取前需充分研磨,可以增大反应物的接触面积,增大反应速率,故答案为:增大接触面积从而使反应速率加快;
②根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣1为Fe(OH)3,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2,溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,产品的产量减少,故答案为:Fe3+;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少。


科目:高中化学 来源: 题型:
【题目】已知下列物质在一定条件下氧化KI时,自身发生如下变化:Fe3+→Fe2+,Cl2 →Cl,MnO4→Mn2+,HNO3→NO2,如果分别等物质的量的下列这些物质与足量的KI反应得到最多的是
A.Fe3+B.Cl2C.MnO4D.HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(1)Zn(s)+1/2O2(g)==ZnO(s),ΔH= -348.3kJ/mol (2) 2Ag(s)+1/2 O2(g)== Ag2O(s),ΔH= -31.0kJ/mol 则ZnO(s)+ 2Ag(s)== Zn(s)+ Ag2O(s)的ΔH等于( )
A. -317.3kJ/molB. -379.3kJ/molC. -332.8 kJ/molD. 317.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、M、X、Y、Z为原子序数依次增大的前四周期元素,非金属元素W所在周期数等于族序数;M最外层电子数是电子层数的两倍;X与M同族,X单质与O2反应生成化合物XO2;Y 是第三周期原子半径最小的元素;Z是生活中常见金属,既不属于主族,也不属于副族。回答下列问题:
(1) W与M可以形成多种化合物,写出其中最简单化合物的电子式_____________。
(2) 已知:①X的单质结构为( ,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为(
,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为( ,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
②有关键能的数据如下表:
化学键 | X-O | O=O | X-X |
键能(kJ/mol) | 460 | 498.8 | 176 |
写出单质X 在O2中燃烧的热化学方程式________________________。(用具体元素符号书写方程式)
(3) 写出Z的单质与H2O反应的化学方程式_____________________________________。
(4)Y和Z形成的化合物的水溶液呈酸性的原因_______________________________(用离子方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 基态Si原子中,电子占据的最高能层符号为________,该能层具有的原子轨道数为_________。
(2) CH3COOH中C原子轨道杂化类型为_________;1molCH3COOH分子含有σ键的数目为_________。
(3) 复化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。

①基态硼原子的电子排布式为__________。
②六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为__________,分析其结构,与石墨相似却不导电,原因是__________。
③NH4BF4 (氟硼酸铵)是合成氮化硼纳米管原料之一。1mol NH4BF4 含有__________mol 配位键。
(4) Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______,微粒之间存在的作用力是__________。
(5) 晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为金刚石的晶胞,其中原子坐标参数A为(0,0 ,0);B为(![]() ,0,
,0, ![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为__________。
,0)。则D原子的坐标参数为__________。
②晶胞参数,描述晶胞的大小和形状,已知金刚石晶胞参数acm,其密度为__________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故处理方法正确的是
A.电线短路失火时,用大量的水灭火
B.NaOH浓溶液溅到皮肤,立即用水冲洗,然后涂上稀硼酸溶液
C.浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
D.钠着火时,立即用水灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据金属及其化合物的所学知识回答下列问题:
(1)常温下,在没有氧气存在时,铁与水几乎不反应,但在高温时,铁能与水蒸气反应,写出化学反应方程式:_______________________________。
(2)待(1)中反应完全,反应产物中Fe元素化合价为_________,该产物与盐酸反应的离子方程式为:__________________________________。
(3)将铁粉投入到盛有Cu2+和Fe3+的溶液中,反应完毕时,若烧杯底部有固体剩余,在所涉及的金属元素内溶液中一定不含有的金属离子是________(填离子符号),写出证明溶液中不含有该离子的实验操作:______________________。
(4)某同学将铁、铜混合粉末14.8 g加入到100 mL 4.0 mol/L FeCl3溶液中,充分反应后,烧杯底部还有剩余固体,其质量为2.8 g,则原固体混合物中铜的质量是______g,反应所得溶液中的Fe2+物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
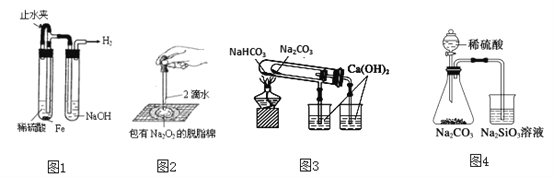
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学设计实验,完成了![]() 和
和![]() 溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究。
溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究。
实验I:
| 实验现象 |
i.加入 ii.取少量i中清液于试管中,滴加2滴1 mol/L |
已知:i.![]()
ii.![]() 的性质与卤素单质相似,且氧化性:
的性质与卤素单质相似,且氧化性:![]()
(1)![]() 和
和![]() 溶液反应的离子方程式是______。
溶液反应的离子方程式是______。
(2)现象ii中溶液最终呈红色的一种可能原因是:![]() 和
和![]() 生成(SCN)2,进而使清液中的
生成(SCN)2,进而使清液中的![]() 氧化为
氧化为![]() 。设计如下实验II进行验证:
。设计如下实验II进行验证:

① 认为原因被证实的现象iii是________。
② 加入CuCl2溶液后反应的离子方程式是_________。
(3)有的同学认为实验II并不严谨,不能证实(2)中猜想,改进的实验III如下:

① 对比实验II,说明实验III更加严谨的原因:________。
② 改进后的实验才能证实(2)中猜想,依据的上述现象是______。
(4)改变实验I的试剂添加顺序及用量,设计实验IV:
实验IV | 现象 |
向2 mL 1 mol/L | 充分振荡,溶液红色褪去,有白色沉淀生成 |
① 实验IV中溶液红色褪去,不能说明![]() 反应完全。结合实验II或III,说明理由:_______。
反应完全。结合实验II或III,说明理由:_______。
②实验小组同学进行讨论,设计了下列实验方案,能够检测红色褪去后的溶液是否含有![]() 的是_______(填序号)。
的是_______(填序号)。
a.排除溶液中的![]() 后,再加入足量
后,再加入足量![]() 溶液进行检测
溶液进行检测
b.排除溶液中的![]() 后,再加入足量
后,再加入足量![]() 溶液进行检测
溶液进行检测
c.选择一种只与![]() 反应的试剂,观察是否出现特征现象
反应的试剂,观察是否出现特征现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com