
【题目】可逆反应:3N(s)![]() X(g)+2Y(g) ΔH<0在恒容绝热密闭容器中反应,达到平衡状态的标志是( )
X(g)+2Y(g) ΔH<0在恒容绝热密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolX的同时生成3nmol N
②混合气体的平均相对分子质量不再改变
③气体X百分含量不再改变
④混合气体的密度不再改变的状态
⑤容器的压强不再改变
⑥容器温度不再改变
A.①⑤⑥B.①②③④⑤⑥C.①④⑤⑥D.①②③⑤⑥
【答案】C
【解析】
①单位时间内生成nmolX,会消耗3nmolN,同时生成3nmol N,N的物质的量不变,反应达到平衡状态,①符合题意;
②该反应只有生成物是气体,二者的物质的量的比恒定不变,因此任何情况下混合气体的平均相对分子质量都不变,不能据此判断反应是否处于平衡状态,②不符合题意;
③该反应只有生成物是气体,二者的物质的量的比恒定不变,因此任何情况下混合气体中X百分含量都不变,不能据此判断反应是否处于平衡状态,③不符合题意;
④反应在恒容密闭容器中进行,反应物为固体,若未达到平衡,气体的质量会发生变化,气体的密度也会改变,若混合气体的密度不再改变,说明反应处于平衡状态,④符合题意;
⑤该反应反应前后气体的物质的量发生变化,由于容器是恒容密闭容器,若气体的物质的量不变,则容器内气体的压强不变,反应达到平衡状态,⑤符合题意;
⑥该反应的正反应是放热反应,若反应达到平衡状态,则反应过程的能量消耗与产生相同,容器温度不变,故可据此判断反应处于平衡状态,⑥符合题意;
综上所述可知,可判断反应处于平衡状态的为①④⑤⑥,故合理选项是C。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+,又含有Fe3+,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质,0.425mol FeCl2 和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 成的H2S气体在标准状况下的体积为2.24L
D. 该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol/L的氨水滴定10.00 mL 0.1 mol/L的酸HA,所加氨水的体积(V)与溶液中lg![]() 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
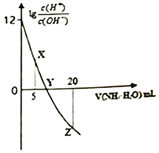
A. X点:c(A-)>c(H+)>c(NH4+)>c(OH-) B. Y点:V(NH3·H2O) <10.00 mL
C. Z点:2c(A-)= c(NH4+)+c(NH3·H2O) D. HA的电离方程式为HA=H++A-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种物质存在如图转化关系,下列判断正确的是
![]()
A.若W是一种常见的金属单质,则X可能为![]()
B.若W为强碱,Y为白色难溶于水的固体,则工业上可以电解X的水溶液来制取其中所含的金属
C.若W固体俗称干冰,则Y晶体中的阴、阳离子个数比为1∶1
D.若W是![]() ,则Y一定是酸性氧化物
,则Y一定是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间
浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
(Ⅰ)无催化剂、不加热 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 |
(Ⅱ)无催化剂、加热 | 360 | 480 | 540 | 720 |
(Ⅲ)MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
该小组在设计方案时,考虑了浓度、a:___________b:___________等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:_____________。
(2)将质量相同但颗粒大小不同的MnO2分别加入到5 mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂 (MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生反应的化学方程式:______________________。
②实验结果说明催化剂作用的大小与________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学给分子式为C12H26的某烷烃命名为“2,4-二甲基-3,5-二乙基己烷”,另一同学认为这样命名有错误,有关该烷烃的说法,你认为正确的是
A. 若该烷烃由单烯烃与氢气加成而得,则原单烯烃可有11种不同结构
B. 该烷烃的一氯代物有10种
C. 该烷烃正确名称应为2,4,5-三甲基-3-乙基庚烷
D. 该烷烃分子中含有5个支链
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)15.6gNa2X中含Na+0.4mol,则Na2X的摩尔质量是________。
(2)设NA为阿伏加德罗常数的数值,如果ag氧气中含有的分子数为b,则cg氧气在标准状况下的体积约是_______(用含NA的式子表示)。
(3)某溶液由Mg2+、Al3+、Cl-、SO42-四种离子组成,测得其中Al3+、SO42-、Cl-的物质的量浓度之比为3:1:13,则溶液中Mg2+、Al3+、SO42-的物质的量浓度之比为___。
(4)奥运金牌“金镶玉”环形碧玉由昆仑玉制成,昆仑玉的成分可简单看成是Ca2Mg5Si8O22(OH)2,则其用氧化物的形式可表示为_______。
(5)下列各项与胶体性质无关的有________。
①卤水点豆腐 ②明矾净水 ③静电除尘 ④油水分离 ⑤血液透析 ⑥三角洲形成 ⑦酸碱中和 ⑧雨后彩虹和海市蜃楼 ⑨臭氧消毒
(6)CaH2的电子式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用CO和H2合成甲醇,反应方程式为:
CO (g) +2H2 (g) ![]() CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。

(1)当起始n (H2):n(CO) =2,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率v(H2)=____。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH (g),达新平衡时H2的转化率将_______(选填“增大”、“减小”或“不变”)。
(2)当起始n (H2):n(CO) =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_____点(选填“D”、“E”或“F”)。
(3)由图2可知该反应的△H_____0(选填“>”、“<”或“=”,下同),压强pl____p2;当压强为p2时,在y点:v(正)____v(逆)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com