
【题目】芳香族化合物C的分子式为C9H9OCl,C分子中有一个甲基且苯环上只有一条侧链:一定条件下C能发生银镜反应,C与其他物质之间的转化如下图所示:
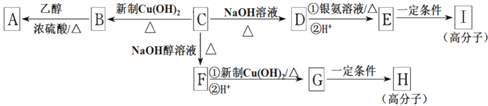
(1)C的结构简式是___________。
(2)E中含氧官能团的名称是________;C→F的反应类型是________.
(3)写出下列化学方程式:
G在一定条件下合成H的反应___________。
(4)有的同学认为B中可能没有氯原子,你是____(填“同意”或“不同意”),你的理由______.
(5)Ⅰ.D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体结构简式_________.
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
④核磁共振氡谱有4个峰
Ⅱ.与D同属于芳香族化合物E的分子式是C8H3Cl2。E的苯环上的一溴取代物只有一种,则E可能的结构有_________________种。
【答案】 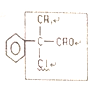 羧基羟基 消去反应
羧基羟基 消去反应  同意 在碱性环境中氯原子可能水解
同意 在碱性环境中氯原子可能水解 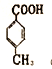 7
7
【解析】(1)C的分子式为![]() ,含有醛基,且能发生卤代物的消去反应,故C中苯环上唯一的1条支链中含有醛基和甲基,故C的结构简式为
,含有醛基,且能发生卤代物的消去反应,故C中苯环上唯一的1条支链中含有醛基和甲基,故C的结构简式为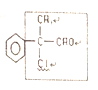 。
。
(2)C→D为卤代烃水解反应,D为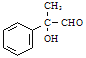 ;D→E醛的氧化反应,E为
;D→E醛的氧化反应,E为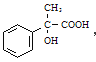 ,所以E的含氧官能团有羧基和羟基;由反应条件可知C→F为卤代烃的消去反应。
,所以E的含氧官能团有羧基和羟基;由反应条件可知C→F为卤代烃的消去反应。
(3)C经消去反应生成的F为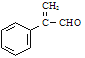 ,F→G为醛的氧化反应,G含有碳碳双键,故G→H为加聚反应,即
,F→G为醛的氧化反应,G含有碳碳双键,故G→H为加聚反应,即 。
。
(4)卤代烃的水解条件为强碱水溶液加热,![]() 属于强碱,故B中可能没有氯原子。
属于强碱,故B中可能没有氯原子。
(5)W是D的同系物,且分子式为![]() ,故W为
,故W为![]() 。其同分异构体不含酚羟基和酯基,但含有羧基,故苯环上的侧链有两种情况:
。其同分异构体不含酚羟基和酯基,但含有羧基,故苯环上的侧链有两种情况:
①1个支链:![]() ②2个支链:
②2个支链:![]() ,邻间对三种分布,故共4种同分异构体;分子中共有4种氢原子,符合题意的只有
,邻间对三种分布,故共4种同分异构体;分子中共有4种氢原子,符合题意的只有![]() 在苯环上对位分布的结构,即
在苯环上对位分布的结构,即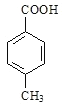 。
。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】北京航空航天大学教授偶然中发现米虫吃塑料,受此启发进行了系列实验,证实黄粉虫的肠道微生物可降解聚苯乙烯(PS),蜡虫可降解聚乙烯(PE)。聚苯乙烯在虫肠内降解的示意图如下,下列说法正确的是
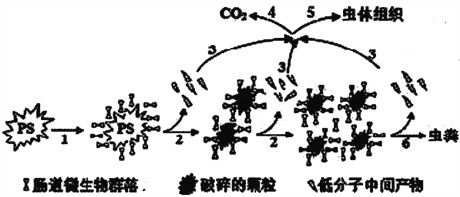
A. 在虫肠内微生物作用下,聚苯乙烯断裂碳碳双键
B. 在虫肠内微生物作用下,聚苯乙烯直接降解为CO2分子
C. 在虫肠内微生物作用下,聚苯乙烯发生降解,分子量降低
D. 聚乙烯与聚苯乙烯是同系物,具有烯烃的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子化合物的叙述正确的是( )
A.离子化合物中都含有离子键
B.离子化合物中的阳离子只能是金属离子
C.离子化合物一定可以导电
D.溶于水可以导电的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铜在自然界中主要以单质的形式存在
B. 工业上常用电解饱和食盐水的方法制备金属钠
C. 工业上常用焦炭在高温下直接将氧化铁还原炼铁
D. 在海水中加入石灰乳可得氢氧化镁沉淀,这是从海水中富集镁的基本方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、磷元素在化学中有很重要的地位,硼、磷及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。回答下列问题。
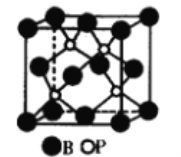
(1)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图是磷化硼晶体的晶胞示意图,则磷化硼的化学式为_____,该晶体的晶体类型是_______。
(2)硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连[如下图]。
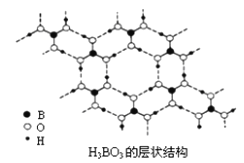
①硼酸分子中B最外层有_______个电子,1molH3BO3的晶体中有_______mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+离子。则硼酸为____________元酸,[B(OH)4]-含有的化学键类型为________。
(3)四(三苯基膦)钯分子结构如图:
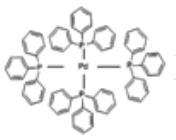
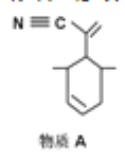
P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为_____;判断该物质在水中溶解度并加以解释________。该物质可用于如图所示物质A的含成。物质A中碳原子杂化轨道类型有_______个;一个A分子中手性碳原子数目为_____。
(4)在图示中表示出四(三苯基膦)钯分子中配位键____________
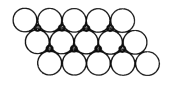
(5)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距高最近的两个阳离子核间的距离为_______(用合有a的代数式表示)。在一定温度下,Ni0晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为_______g(氧离子的半径为1.40×10-10m,令![]() ≈l.7)。
≈l.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列叙述正确的是
A. 在沸水中加入0.1mL5mol/L的FeCl3制得胶体,Fe(OH)3胶体粒子数目为5×10-4NA
B. 0.5mol/L MgCl2溶液中含有Cl-的数目为NA
C. 标准状况下,5.6 L H2O含有的电子数目为2.5NA
D. 13.2g CO2和N2O形成的混合物含有的原子数目为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4。Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为_____________________________。
II.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制务高纯PbO,其主要流程如下:
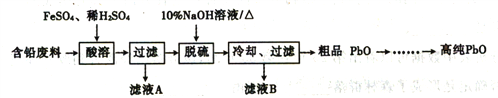
(2)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成1molPbSO4时转移电子的物质的量为____mol。
(3)已知:PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)=NaHPbO2(aq),其溶解度曲线如图所示:
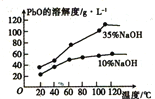
结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量_________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,___________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)工业上利用硫化氢除去滤液A中少量的Pb2+,发生的反应为Pb2++H2S![]() PbS↓+2H+,该反应的平衡常数为_____________。(H2S的Ka1=1.5×10-7,Ka2=7.0×10-15,PbS的Ksp=8.4×10-28)
PbS↓+2H+,该反应的平衡常数为_____________。(H2S的Ka1=1.5×10-7,Ka2=7.0×10-15,PbS的Ksp=8.4×10-28)
(5)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示:

①阴极的电极反应式为________________________;
②当有2.07gPb生成时,通过质子交换膜的n(H+)=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com