
【题目】下列说法正确的是
A. 铜在自然界中主要以单质的形式存在
B. 工业上常用电解饱和食盐水的方法制备金属钠
C. 工业上常用焦炭在高温下直接将氧化铁还原炼铁
D. 在海水中加入石灰乳可得氢氧化镁沉淀,这是从海水中富集镁的基本方法
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
请完成下列填空:
(1)写出一个包含上述体系中七种物质的氧化还原反应方程式(无需配平):_________________________;上述反应中,还原产物是_____________,每转移1 mol电子,生成Cl2 _____ L(标准状况)。
(2)上述反应体系中,有些短周期元素的简单离子核外电子排布相同,它们的简单离子半径由大到小的顺序为______________(用离子符号表达)。
(3)氯原子的最外层电子排布式为_____________________,氯原子核外共有____种不同运动状态的电子。
(4)在上述反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。比较该反应中的氧化剂和氧化产物的氧化性强弱_______>________。
(5)请用原子结构理论解释上述含7种物质的氧化还原反应体系中,属于同一主族两种元素非金属性的强弱,____>______;______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PVAc是一种具有热塑性的树脂,可合成重要高分子材料M,合成路线如下:
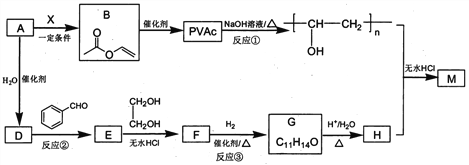
己知:R、Rˊ、Rˊˊ为H原子或烃基
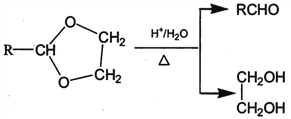
I. R'CHO+ R"CH2CHO![]()
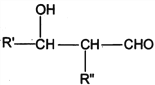
![]()
![]()
II. RCHO+![]()
![]()
(1)标准状况下,4.48L气态烃A的质量是5.2g,则A的结构简式为___________________。
(2)己知A→B为加成反应,则X的结构简式为_______;B中官能团的名称是_________。
(3)反应①的化学方程式为______________________。
(4)E能使溴的四氯化碳溶液褪色,反应②的反应试剂和条件是_______________________。
(5)反应③的化学方程式为____________________________。
(6)在E→F→G→H的转化过程中,乙二醇的作用是__________________________。
(7)己知M的链节中除苯环外,还含有六元环状结构,则M的结构简式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定铝热反应实验所得“铁块”的成分,某学生兴趣小组设计实验流程如图所示。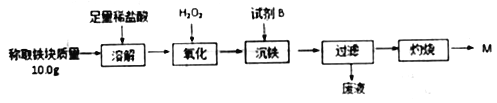
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
(1)取溶解操作得到的溶液,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的氧化铁外,还有一个原因是_______________。
(2)沉铁操作应调节溶液pH的范围的为________,试剂B 选择______。(填序号)
a.稀盐酸 b.氧化铁 c.MgCO3固体 d.氨水
(3)已知常温下Fe(OH)3的Ksp=1.1×10-36,则铁完全沉淀时溶液中c(Fe3+)=_____mol/L。
(4)根据流程得到的固体M质量_____(填“能”或“不能”)计算出铁块中金属铁的质量,原因是________________。
(5)另有小组采用滴定的方式测定“铁块”中铁的含量(铁元素只存在Fe和Fe2O3),测定方式如下:
I.取10g“铁块”粉碎,加入足量氢氧化钠溶液充分反应,过滤、洗涤、干燥,得到8.88g固体。将固体加入足量盐酸溶解,获得200mL溶液A;
II.取出10mL 溶液A 于锥形瓶,先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+,除去过量的Sn2+;
III.加入一定量的硫酸和磷酸,并滴加指示剂。再向锥形瓶中滴加0.1000mol/LK2Cr2O7溶液,恰好完全反应时,共消耗12.50mL K2Cr2O7溶液。发生反应:Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O
①步骤I中加入足量氢氧化钠溶液的作用为________________________。
②请计算样品中Fe单质的质量分数__________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法,![]() 的名称为2,4,5-三甲基己烷
的名称为2,4,5-三甲基己烷
B. 3-甲基-3-乙基戊烷的一氯取代产物有6种
C. 化合物![]() 是苯的同系物
是苯的同系物
D. 分子![]() 中,位于同一平面上碳原子最多有6个
中,位于同一平面上碳原子最多有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁的工业流程如图所示,下列说法不正确的是
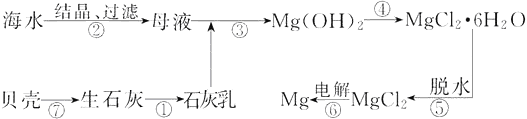
A. 用此法提取镁的优点之一是原料来源丰富
B. 在实验室进行②的操作需用到坩埚、坩埚钳、玻璃棒、酒精灯
C. 步骤⑥电解MgCl2时,副产物Cl2可以循环利用
D. 上述工艺流程中的反应未涉及置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物C的分子式为C9H9OCl,C分子中有一个甲基且苯环上只有一条侧链:一定条件下C能发生银镜反应,C与其他物质之间的转化如下图所示:
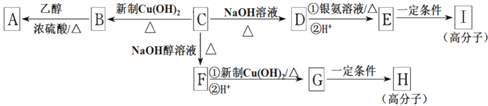
(1)C的结构简式是___________。
(2)E中含氧官能团的名称是________;C→F的反应类型是________.
(3)写出下列化学方程式:
G在一定条件下合成H的反应___________。
(4)有的同学认为B中可能没有氯原子,你是____(填“同意”或“不同意”),你的理由______.
(5)Ⅰ.D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体结构简式_________.
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
④核磁共振氡谱有4个峰
Ⅱ.与D同属于芳香族化合物E的分子式是C8H3Cl2。E的苯环上的一溴取代物只有一种,则E可能的结构有_________________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面图示回答问题:
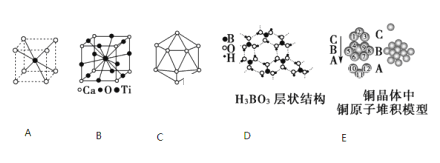
(1)A图是某离子化合物的晶胞,阳离子位于中间,阴离子位于8个顶点,该化合物中阳、阴离子的个数比是________。
(2)B图若Ca、Ti、O形成的某钙钛矿型晶体结构如B图,其化学式为________。
(3)原子晶体硼的基本结构单元都是由硼原子组成的正二十面体,如C图。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察该图,推断这个基本结构单元所含硼原子个数、键角、B—B键的个数依次为________、________、_______。
(4)图D所示的物质结构中最外层已达8电子结构的原子是________(填元素符号),H3BO3晶体中B原子个数与极性键个数比为________;
(5)金属铜具有很好的延展性、导电传热性,对此现象最简单的解释是用“________”理论;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释中,不正确的是![]()
A. 水在结冰时体积膨胀,是由于水分子中存在分子间氢键
B. 水很稳定![]() 以上才会部分分解
以上才会部分分解![]() 是因为水中含有大量的氢键所致
是因为水中含有大量的氢键所致
C. MgO的熔点比![]() 高主要是因为MgO的晶格能比
高主要是因为MgO的晶格能比![]() 大
大
D. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com