
【题目】TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,M=240g·mol—1。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。
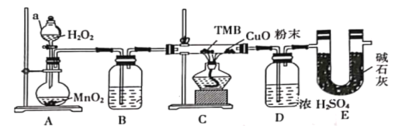
(1) 写出A中的化学反应方程式:__________________;
(2) B 中试剂是___________,作用是________________ ;
(3) 装置C中CuO粉末的作用为________________。
(4) 理想状态下,将4.80 gTMB样品完全氧化,点燃C处酒精灯,实验结束时测得D增加3.60 g,E增加14.08 g,则TMB的分子式为____________。
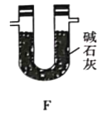
(5)有同学认为,用该实验装置测得的TMB分子式不准确,应在干燥管E后再添加一个装有碱石灰的干燥管F。你认为是否需要添加F装置__________(填“需要”或“不需要”),简述理由________________。
【答案】2H2O2 ![]() 2H2O+O2↑ 浓硫酸 干燥 O2,防止带入 D或E 中引起增重 使 TMB 不充分燃烧生成 CO 全部转化为 CO2 C16H20N2 需要 防止外界空气中的 CO2 和 H2O 进入 E 中,避免对 E 处吸收二氧化碳的定量检测造成干扰
2H2O+O2↑ 浓硫酸 干燥 O2,防止带入 D或E 中引起增重 使 TMB 不充分燃烧生成 CO 全部转化为 CO2 C16H20N2 需要 防止外界空气中的 CO2 和 H2O 进入 E 中,避免对 E 处吸收二氧化碳的定量检测造成干扰
【解析】
根据装置图,A中过氧化氢在二氧化锰催化作用下生成氧气,进入装置C的气体需要干燥,生成的氧气在B用浓硫酸干燥,干燥的氧气在C中将TMB氧化为二氧化碳、水和氮气,反应后用浓硫酸吸收水,用碱石灰吸收二氧化碳,以确定其中所含碳、氢、氮原子的比例关系。据此分析解答。
(1)过氧化氢在二氧化锰催化作用下生成氧气,反应的化学方程式为2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)进入装置C的气体需要干燥,因此B中试剂为浓硫酸,可用于干燥氧气,防止带入D中引起增重,故答案为:浓硫酸;干燥O2,防止带入D中引起增重;
(3)装置C中CuO粉末可以使TMB不充分燃烧生成的一氧化碳全部转化为二氧化碳,保证碳元素全部转化为二氧化碳,被E吸收,故答案为:使TMB不充分燃烧生成的一氧化碳全部转化为二氧化碳;
(4)实验后称得A装置从用的先后顺序排列质量分别增加3.60g、14.08g、0.14g,则m(H2O)=3.60g,m(CO2)=14.08g,而0.14g为空气中的CO2和H2O进入装置中的质量,则n(H2O)=![]() =0.2mol,n(H)=0.4mol,m(H)=0.4g,n(CO2)=
=0.2mol,n(H)=0.4mol,m(H)=0.4g,n(CO2)=![]() =0.32mol,n(C)=0.32mol,m(C)=0.32mol×12g/mol=3.84g,所以m(N)=4.80g-0.4g-3.84g=0.56g,n(N)=
=0.32mol,n(C)=0.32mol,m(C)=0.32mol×12g/mol=3.84g,所以m(N)=4.80g-0.4g-3.84g=0.56g,n(N)=![]() =0.04mol,则:n(C)∶n(H)∶n(N)=0.32mol∶0.4mol∶0.04mol=8∶10∶1,TMB的相对分子质量为240,设分子式为:C8nH10nNn,则有:12×8n+10n+14n=240,解得n=2,所以分子式为C16H20N2,故答案为:C16H20N2;
=0.04mol,则:n(C)∶n(H)∶n(N)=0.32mol∶0.4mol∶0.04mol=8∶10∶1,TMB的相对分子质量为240,设分子式为:C8nH10nNn,则有:12×8n+10n+14n=240,解得n=2,所以分子式为C16H20N2,故答案为:C16H20N2;
(5)装置E中的碱石灰会吸收空气中的水蒸气和二氧化碳,使实验数据产生误差,因此该实验需要添加F装置,防止外界空气中的 CO2 和 H2O 进入 E 中,避免对 E 处吸收二氧化碳的定量检测造成干扰;故答案为:需要;防止外界空气中的 CO2 和 H2O 进入 E 中,避免对 E 处吸收二氧化碳的定量检测造成干扰。


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验,请回答下列问题:
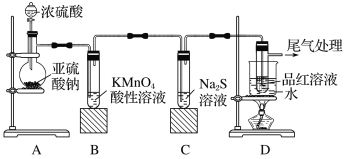
(1)装置A中盛放亚硫酸钠的仪器名称是__。
(2)实验过程中,装置B中发生的现象是__,说明SO2具有的性质是__。
(3)装置B中发生反应的离子方程式为__。
(4)尾气可采用__溶液吸收,离子方程式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
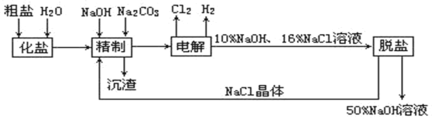
依据上图,完成下列填空:
(1)用惰性电极电解饱和食盐水时,与电源正极相连的电极上所发生的电极反应式为_____________;与电源负极相连的电极附近,溶液pH______(选填:不变、升高或下降)。
(2)如果粗盐中SO42-含量较高,必须加钡剂除去,该钡试剂可以是_________;
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_______________、_______________;
(4)氯碱工业所用的隔膜电解装置,广泛应用于多种化工产品生产,如工业上用惰性电极电解Na2CO3溶液得到含NaHCO3,原理如下图所示。
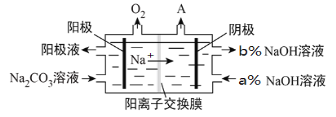
阴极产生的物质A的化学式为__________,a%_____b%(填“<、>、=”),NaHCO3产生在_______室(填“阴极”或“阳极”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,处理锌矿进行综合利用,多采用传统的“高氧酸浸法”,但该法也存在一些缺点。最近,有文献报道:用高铁闪锌矿(含有ZnS、FeS、CuS、CdS及少量SiO2等)为原料,采用“高氧催化氧化氨浸法”可以联合制取Cu2O(红色)、CdS(黄色)、锌钡白(白色)三种颜料,其流程如图:
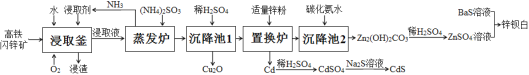
已知:
Ⅰ:浸取剂由碳酸铵、氨水、双氧水等组成;
Ⅱ:浸渣为S、Fe(OH)CO3、SiO2等不溶性物质;
Ⅲ:浸取液中含有[Zn(NH3)4]2+、[Cu(NH3)4]2+、[Cd(NH3)4]2+;
Ⅳ:Cu+在溶液中不存在,但可以与NH3形成稳定的[Cu(NH3)2]+。
回答下列问题:
(1)为加快浸取速度,可以采取的措施是(任答两项)_______;在实际生产中采取常温下浸取而不采用加热的方法,其原因是___。
(2)浸取釜中有O2参与生成浸渣Fe(OH)CO3的离子方程式为_______。
(3)蒸发炉中加入(NH4)2SO3的主要作用是_________;沉降池1中加入稀H2SO4的作用是_______。
(4)在制取ZnSO4和CdSO4时使用硫酸的量要适当,如果硫酸过量,产生的后果是______。
(5)无论采用“高氧酸浸法”还是“高氧催化氧化氨浸法”,其前期处理,都要经过用浸取剂浸取这一步,不同的是“高氧酸浸法”需先高温焙烧,然后再用硫酸浸出。两种方法比较,“高氧酸浸法”存在的缺点是(任答两条)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把小块木炭在酒精灯上烧至红热,迅速投入热的浓硝酸中,发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧发出光亮。
(1)写出红热木炭被热的浓硝酸氧化为CO2的化学方程式_________。
(2)木炭与浓硝酸反应过程中还伴随着浓硝酸的分解,除了产生氧气外,也产生红棕色气体。相同条件下该分解反应产生的氧气与红棕色气体的体积之比为_________。
(3)某研究性学习小组的同学对“木炭在液面上迅速燃烧发出光亮”的原因做出3个猜想:
猜想一:甲同学认为空气中O2支持木炭燃烧
猜想二:乙同学认为浓硝酸分解产生的O2支持木炭燃烧
猜想三:丙同学认为反应产生的NO2支持木炭燃烧
①根据木炭在空气中燃烧的现象,甲同学的猜想明显不合理,理由是_________。
②理论分析乙同学的猜想也不正确,原因是_________。
③要证实丙同学的猜想,还需补充的实验方案是_________(请写出实验操作、现象和结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下三个热化学方程式:
H2(g)+1/2O2(g)== H2O(g) ΔH=a kJ·mol-1
H2(g)+1/2O2(g)== H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)== 2H2O(l) ΔH=c kJ·mol-1
关于它们的下列表述正确的是( )
A.2b=cB.a、b和c均为正值C.a=bD.它们都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的![]() 元素,用元素符号或化学式填空回答以下问题:
元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 |
|
| ||||||
三 |
|
|
|
|
|
| ||
四 |
|
|
(1)化学性质最不活泼的元素原子的原子结构示意图为________;
(2)元素![]() 、
、![]() 的简单氢化物中的稳定性最强的是______________
的简单氢化物中的稳定性最强的是______________![]() 用化学式表示
用化学式表示![]() ;
;
(3)元素的最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是_______,呈两性的氢氧化物是_______________,元素![]() 的最高价氧化物对应水化物中含有的化学键类型为________________;
的最高价氧化物对应水化物中含有的化学键类型为________________;
(4)在![]() 四种元素中,简单离子半径最小的是_________;
四种元素中,简单离子半径最小的是_________;
(5)![]() 的电子式为___________;
的电子式为___________;![]() 的电子式为_________;
的电子式为_________;
(6)在![]() 与
与![]() 的单质中,氧化性较强的是__________,用化学反应方程式证明:___________________________。
的单质中,氧化性较强的是__________,用化学反应方程式证明:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜是由铜和锌组成的合金,在黄铜中加入镍可显著提高黄铜在大气中和海水中的耐蚀性。回答下列问题:
(1)基态Ni2+的核外电子排布式为____________________,有_______个未成对电子。
(2)CuSO4溶液里逐滴滴入过量氨水,形成深蓝色溶液。
①深蓝色的溶液 是因为生成了一种配离子,其离子符号为____________________
其中配位原子是____________ 。
②NH3分子的空间构型是_______。NH3的键角______(填大于或小于)H2O,原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com