
【题目】下列说法不正确的是( )
A.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池在放电过程中,负极质量增加,正极质量也增加
B.金属铝的冶炼流程为: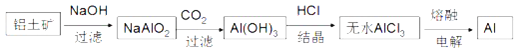
C.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀,但加热反应剧烈
D.一定条件下,使用催化剂能加快反应速率但不提高反应物的平衡转化率
【答案】B
【解析】
A、铅蓄电池在放电过程中,Pb作负极,在反应中失去电子生成![]() ,反应式为:
,反应式为:![]() ,硫酸铅是固体,负极质量增重,正极电极反应式为
,硫酸铅是固体,负极质量增重,正极电极反应式为![]() ,正极质量增加,故A正确;
,正极质量增加,故A正确;
B、铝土矿的主要成分是![]() ,此外还含有少量
,此外还含有少量![]() 、
、![]() 等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,过滤;滤液用二氧化碳酸化时,将硅酸钠和
等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,过滤;滤液用二氧化碳酸化时,将硅酸钠和![]() 转化为硅酸和
转化为硅酸和![]() 沉淀,得不到纯净的氢氧化铝;另外不能通过电解熔融的氯化铝冶炼铝,故B错误;
沉淀,得不到纯净的氢氧化铝;另外不能通过电解熔融的氯化铝冶炼铝,故B错误;
C、常温下,铁和浓硝酸反应生成一层致密的氧化物薄膜而阻止了进一步反应,所以可以保护内部金属不被腐蚀,但加热反应剧烈,![]() (浓)
(浓)![]()
![]() ,故C正确;
,故C正确;
D、催化剂能降低反应所需的活化能,则能加快反应速率,但是不改变平衡,所以不改变平衡转化率,故D正确;
故选B。


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】下列有关硫、氮单质及其化合物的叙述正确的是( )
A.SO2、NO2均为酸性氧化物
B.“雷雨肥庄稼”与氮的固定有关
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.亚硫酸钠可长期暴露在空气中,不易变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下在一容积恒为2L的容器内发生反应:2A(g)+B(g)2C(g),已知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变,下列说法正确的是( )
A.2s内用物质A表示的平均反应速率为0.6mol/(L·s)
B.2s内用物质B表示的平均反应速率为0.6mol/(L·s)
C.2s后每有0.6mol的物质B生成,同时就有0.6mol物质C生成
D.反应前后的压强比为10:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,回答下列问题:

(1)装置B中PbO2上发生的电极反应方程式为___,盐桥中K+移向___(填“装置B”或“装置C”)。
(2)装置A中总反应的离子方程式为___。
(3)若装置E中的目的是在Cu材料上镀银,则X为___,极板N的材料为___。
(4)装置D中右侧石墨电极反应式为:___;
(5)某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如图所示,当该装置工作时,按要求填空:
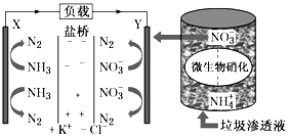
①电流由极___(填“X→Y”或“Y→X”),当电路中流过7.5mol电子时,共产生标准状况下N2的体积为___;
②Y极发生的反应为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是( )
A.配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1,则可证明醋酸是弱电解质
C.取等体积等浓度的CH3 COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质
D.测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于敞口容器中的反应:Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
A.Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B.反应过程正极电极反应式为2H+-2e-=H2↑
C.若将该反应设计成原电池,则Zn为负极
D.若设计成原电池,当有65 g锌溶解时,理论上正极放出22.4 L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题。
(1)羟基的电子式__________ ,(CH3)3COH的名称__________(系统命名法)
(2)从下列物质中选择对应类型的物质的序号填空。
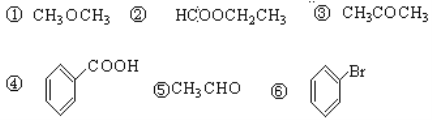
酸:_________ 酯:_________ 醚:_________ 酮:_________
(3)下列各组物质:
① O2和O3 ②乙醇和甲醚;③ 淀粉和纤维素;④ 苯和甲苯;⑤ 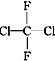 和
和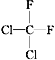 ;⑥
;⑥ ![]() 和
和![]() ;⑦ CH3CH2NO2和
;⑦ CH3CH2NO2和![]()
A.互为同系物的是___________, B.互为同分异构体的是__________,C.属于同一种物质的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某同学探究Na2SO3溶液和铬(VI)盐溶液反应规律的实验记录,已知:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+
2CrO42-(黄色)+ 2H+
序号 | a | b | 现象 | |
| 1 | 2 mL 0.05 mol·L1 K2Cr2O7溶液(pH = 2) | 3滴饱和Na2SO3溶液(pH = 9) | 溶液变绿色(含Cr3+) |
2 | 2 mL 0.1 mol·L1 K2CrO4溶液(pH = 8) | 3滴饱和Na2SO3溶液 | 溶液没有明显变化 | |
3 | 2 mL饱和Na2SO3溶液 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变黄色 | |
4 | 2 mL蒸馏水 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变成浅橙色 |
下列说法不正确的是
A. 实验1中的绿色溶液中含有SO42-
B. 实验1、2的a溶液中所含的离子种类相同
C. 向实验3溶液中继续滴加过量硫酸可使溶液变为浅橙色
D. 实验4的目的是排除稀释对溶液颜色变化造成的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度下,X(g)+2Y(g) ![]() mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是
mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是
A. a=b B. 2a<c C. m<3 D. m>3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com