
【题目】(1)燃料电池已广泛应用于航空领域。如图是一种新型燃料电池装置,其总反应方程式为N2H4+O2=N2+2H2O,通入N2H4(肼)的一极是电池的_______(填“正极”或“负极”),该电极的电极反应式为_________________。放电过程中,溶液中的阳离子移向_______(填“正极”或“负极”)。
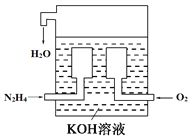
(2)在上述燃料电池中,若完全消耗16 g N2H4,则理论上外电路中转移电子的物质的量为________ mol,消耗氧气的体积为________ L(标准状况)。
(3)与传统火力发电相比,燃料电池的优点是_________、________。
【答案】 负极 N2H4+4OH――4e-=N2+4H2O 正极 2 11.2 高效(能量转化率高) 环境友好(排出物不污染环境)
【解析】(1)根据总反应方程式为N2H4+O2=N2+2H2O可知肼是还原剂,氧气是氧化剂,因此通入N2H4(肼)的一极是电池的负极,电解质溶液显碱性,因此该电极的电极反应式为N2H4+4OH――4e-=N2+4H2O。放电过程中,溶液中的阳离子移向正极。(2)16gN2H4是0.5mol,则理论上外电路中转移电子的物质的量为0.5mol×2=2.0mol,消耗氧气的物质的量是2mol÷4=0.5mol,在标准状况下的体积为11.2L。(3)与传统火力发电相比,燃料电池的优点是能量转化率高、排出物不污染环境,环境友好。


科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如下图,依图所示:
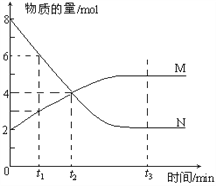
(1)该反应的化学方程式是_____________________。
(2)在图上所示的三个时刻中,_____(填t1、t2或t3)时刻处于平衡状态,此时V正____V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)﹕v(M)= _____。
(3)若反应容器的容积不变,则“压强不再改变”_______(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是_____(选填字母)。
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计计如下图所示装罝(部分夹持装置己略去)进行实验探究:
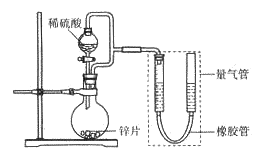
(1)用上述装置探究影响化学反应速率的因素。以生成9.0 mL气体为计时终点,结果为t1>t2。
序号 | V(H2SO4)/mL | C(H2SO4)/mol·L-1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
①比较实验I和Ⅱ可以得出的实验结论是_______________。
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是_________(填序号)。
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用________(填序号)。
A.稀HCl B .NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【安徽省黄山市2017届高三第二次模拟考试理科综合】
硫酸锌用于制造立德粉,并用作媒染剂、收敛剂、木材防腐剂等.现欲用氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)为原料生产ZnSO4·7H2O, 工艺流程如图l:
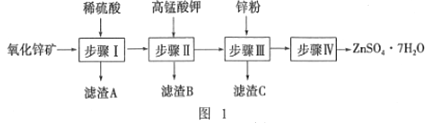
(l)步骤I的操作是_____,滤渣A的主要成分是_____。
(2)步骤I加入稀硫酸进行酸浸时,需不断通入高温水蒸气,其目的是______。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾溶液,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为_____________。
(4)步骤Ⅲ得到的滤液中,阳离子是___________。(不考虑H+)
(5)步骤IV中的烘干操作需在减压低温条件下进行,其原因是_______。
(6)取28.70 gZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图2所示。650℃时所得固体的化学式为_______(填字母序号)。

a. ZnO b. Zn3O(SO4)2 c. ZnSO4 d. ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。

(1)D的氢化物比G的氢化物________________(填“稳定”或者“不稳定”)。
(2)A与E可形成一种极易溶于水的气态化合物,该化合物溶于水后的溶液呈________性(填“酸”、“碱”或“中”)。
(3)C、H、I简单离子的半径由大到小的顺序是________________(用离子符号表示)。
(4)由C和F组成的一种化合物可用作核潜艇中氧气的来源,写出该化合物的电子式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是 ( )
A. CS2为V形的极性分子 B. ClO3—的空间构型为平面三角形
C. SiF4和SO32—的中心原子均为sp2杂化 D. SF6中有6对相同的成键电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3胶体和MgCl2溶液共同具备的性质是( )
A. 分散质微粒可通过滤纸 B. 两者均能透过半透膜
C. 加入盐酸先沉淀,随后溶解 D. 两者均有丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.SiO2是酸性氧化物,它不溶于水也不溶于任何酸
B.木材浸过水玻璃后,具有防腐蚀性能且不易着火
C.因高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强
D.氯气泄漏后,人应逆风且往低处跑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com