
【题目】下列说法正确的是
A.SiO2是酸性氧化物,它不溶于水也不溶于任何酸
B.木材浸过水玻璃后,具有防腐蚀性能且不易着火
C.因高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强
D.氯气泄漏后,人应逆风且往低处跑
科目:高中化学 来源: 题型:
【题目】(1)燃料电池已广泛应用于航空领域。如图是一种新型燃料电池装置,其总反应方程式为N2H4+O2=N2+2H2O,通入N2H4(肼)的一极是电池的_______(填“正极”或“负极”),该电极的电极反应式为_________________。放电过程中,溶液中的阳离子移向_______(填“正极”或“负极”)。
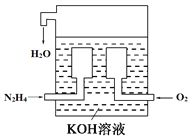
(2)在上述燃料电池中,若完全消耗16 g N2H4,则理论上外电路中转移电子的物质的量为________ mol,消耗氧气的体积为________ L(标准状况)。
(3)与传统火力发电相比,燃料电池的优点是_________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含分子物质的量最多的是
A. 44 g CO2 B. 1.5 mol H2
C. 64 g SO2 D. 3.01×1023个硫酸分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. NA个Fe(OH)3胶体粒子的质量为107 g
B. 12g金刚石含有4NAσ键
C. 14 g分子式为CnH2n的链烃中含有的π键的数目为NA/n
D. 1 mol冰醋酸和1 mol乙醇经酯化反应可生成H2O分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)硼砂中B的化合价为 ,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为 。常温下,若起始电解质溶液pH=1,则pH=2时,溶液中Mg2+浓度为______。当溶液pH=6时, (填“有”或“没有”)Mg(OH)2沉淀析出(已知Ksp[Mg(OH)2]=5.6×10-12)。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为____(提示:I2+2S2O===2I-+S4O)(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺可以用以下三个反应合成:CaO+3C=CaC2+CO↑,CaC2+N2=CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排
布式:_____________________________________________。
CaCN2中阴离子为CN![]() ,与CN
,与CN![]() 互为等电子体的分子有________(填两种化学式),由此可以推知CN
互为等电子体的分子有________(填两种化学式),由此可以推知CN![]() 的空间构型为________,画出CN
的空间构型为________,画出CN![]() 电子式___________。
电子式___________。
(2)尿素分子中C原子采取________杂化。尿素分子的结构简式是________。
(3)三聚氰胺(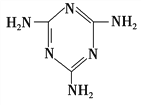 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(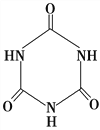 )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
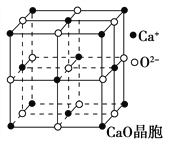
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________。CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常见的几种金属氧化物的性质和用途的说法不正确的是( )
A. 氧化钙可用作干燥剂 B. Fe2O3可用于制作红色油漆和涂料
C. Al2O3可用作耐火材料 D. Na2O2、CuO、FeO都能溶于水,且与水反应都生成相应的碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在容积为10L固定的密闭容器中充入4molNH3和5molO2发生如下反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),5s后,达到平衡并生成1molNO时:
4NO(g)+6H2O(g),5s后,达到平衡并生成1molNO时:
(1)O2的转化率为__________________。
(2)下列能说明该反应已经达到平衡状态的是____________。(填字母选项)
A.容器中气体总质量不变 B.c(O2)不变
C.5v(O2)正 = 4v(NO)逆 D.体系压强不变
(3)降低容器的温度则反应速率______,向该容器中通入Ar,则反应速率_______(选填“增大”、“减小”、“不变”)。
(4)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是________。(填字母选项)。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢
(5)已知对于可逆化学反应mA + nB ![]() pC + qD在一定温度下达到化学平衡时,其平衡常数K的表达式为:
pC + qD在一定温度下达到化学平衡时,其平衡常数K的表达式为:![]() (其中,C为各物质的平衡浓度),则该温度下,上述反应的平衡常数K = ___________________________(用数据表达,列出式子即可)。
(其中,C为各物质的平衡浓度),则该温度下,上述反应的平衡常数K = ___________________________(用数据表达,列出式子即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com