
【题目】氨气在工农业生产中有重要应用。
(1)氨的催化氧化是工业生产硝酸的基础,写出该化学方程式_________。
(2)某化学实验小组同学利用以下装置制备氨,并探究氨的性质(部分仪器已略去)。
请回答:
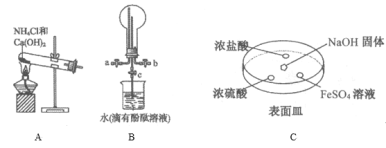
①用装置B收集氨时,氨的进气口是__(选填“a”或“b”)。打开装置B中的活塞c,若观察到烧瓶内产生了红色喷泉,则说明氨具有的性质是______,______。
②向C中NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。浓盐酸液滴附近会出现 _____,(填现象)发生反应的化学方程式为_______。FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O===Fe(OH)2↓+2NH4+和_________。
③为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨的__(填序号)。
【答案】4NH3+5O2![]() 4NO+6H2O a 极易溶于水 溶于水形成的溶液呈碱性 白烟 NH3+HCl=NH4Cl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 BD
4NO+6H2O a 极易溶于水 溶于水形成的溶液呈碱性 白烟 NH3+HCl=NH4Cl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 BD
【解析】
(1)氨的催化氧化生成NO和水;
(2)①根据氨气的水溶性和氨气的密度来确定氨气收集方法-向下排空气法;氨气极易溶与水,能产生喷泉现象,溶于水的氨气反应生成一水合氨,一水合氨是弱碱,电离产生氢氧根离子,具有碱性;
②浓盐酸和浓氨水易挥发,浓盐酸液滴附近会出现白烟,发生HCl与氨气的反应生成氯化铵;氨气与硫酸亚铁溶液反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化生成氢氧化铁,以此解答;
③氨气极易溶于水,可用水吸收氨气,注意防到吸。
(1)氨催化氧化生成NO和水,发生反应的化学方程式是4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)①因为氨气极易溶于水,只能用排气法收集,又因为氨气的密度小于空气的密度,所以应该选择向下排空气法收集,氨气从a口进入空气从b口排出;能够形成喷泉实验是因为氨气极易溶于水这一物理性质,产生红色喷泉是因为氨气溶于水后与水反应生成弱碱一水合氨具有碱性;
②浓盐酸液滴附近会出现白烟,发生HCl与氨气的反应生成氯化铵,该反应为NH3+HCl═NH4Cl;FeSO4与碱反应生成白色沉淀,发生反应为Fe2++2NH3H2O═Fe(OH)2↓+2NH4+,然后出现灰绿色沉淀,过一段时间后变成红褐色,是因氢氧化亚铁被氧化,发生反应为4Fe(OH)2+O2+2H2O═4Fe(OH)3;
③氨气极易溶于水,可用水吸收氨气,但是应该注意防止倒吸,BD都具有防倒吸功能,可以用来吸收氨气,故答案为:BD。


科目:高中化学 来源: 题型:
【题目】科研人员设计的CO2资源化利用的装置如图所示(电解质溶液为稀H2SO4),下列说法错误的是
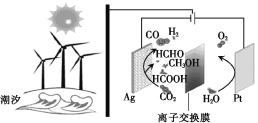
A.该离子交换膜为质子交换膜
B.Ag极上的电势比Pt极上的高
C.电路中每流过4 mol电子,阳极区质量减少36 g
D.太阳能、风能及潮汐能均是可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,能大量共存的离子组是( )
A.能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br-
B.常温下pH=1的溶液中:Fe2+、Mg2+、NO![]() 、Cl-
、Cl-
C.含有大量Fe3+的溶液中:SCN-、I-、K+、Br-
D.能使石蕊试液显红色的溶液中:K+、![]() 、S2-、
、S2-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )

A. 溶液中一定不含CO32﹣,可能含有SO42-和NO3-
B. 溶液中n(NH4+)="0.2" mol
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)︰n(Al3+)︰n(Mg2+)=1︰1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m g氢气和n g氦气的下列说法中,正确的是
A.同温同压下,H2与He的体积比为m∶2n
B.同温同压下,若m=n,则H2与He的分子数之比为2∶1
C.同温同压下,同体积时,H2与He的质量比![]() >1
>1
D.同温同压下,H2与He的密度比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
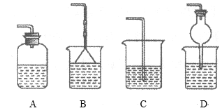
【题目】下列有关实验装置或操作进行的相应实验,能达到实验目的的是( )
A.用图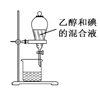 所示装置分离乙醇和碘的混合液
所示装置分离乙醇和碘的混合液
B.用图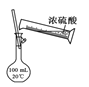 所示操作配制100 mL 0.1 mol·L-1硫酸溶液
所示操作配制100 mL 0.1 mol·L-1硫酸溶液
C.用图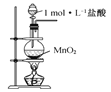 所示装置制取氯气
所示装置制取氯气
D.用图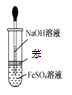 所示装置不能制取Fe(OH)2
所示装置不能制取Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“将少量氯水加入到NaI溶液中”的学生实验产生了大量含碘废液.某研究小组用该含碘废液制备NaI固体,实验流程如下:
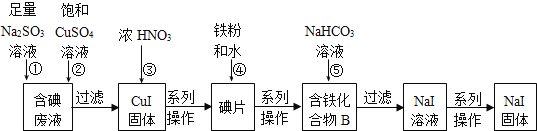
已知:反应②2I-+2Cu2++SO32-+H2O═2CuI↓+SO42-+2H+。回答下列问题:
(1)产生含碘废液的离子方程式为____________。
(2)①中I2与Na2SO3溶液反应的离子方程式为_________。
(3)化合物B中含两种元素,铁元素与另一种元素物质的量之比为3:8,则化合物B的化学式为____。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则⑤的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com