
����Ŀ��̼��Ԫ�أ�C��Si��Ge��Sn��Pb���ĵ��ʼ��仯�������������������й㷺��Ӧ�á��ش��������⣺
��1����̬Snԭ���У��������ռ�ݵ�����ܼ�����Ϊ__________�����ܼ����е�ԭ�ӹ����Ϊ___________________��
��2��Ge�������о�����ͽṹ��Ge�����ľ�������Ϊ_____________��Ge��ͬ���ڵ� As��Se��Ƚϣ���һ�������ɴ�С��˳����_______________��
��3�����ϱ�������������̼(C2O2)�ǽ��Ǵ������һ����ɲ��֣�������в�����״�ṹ��ÿ��ԭ�Ӿ�����8�����ȶ��ṹ��C2O2��̼ԭ�ӵ��ӻ���ʽΪ______________�������ЦҼ���м��ĸ�����Ϊ______________________��
��4��̼����ľ���ṹ�����ڽ��ʯ����ͼ��ʾ����1��̼���辧����ռ_______��̼ԭ�ӣ��������辧������С���ϵ�ԭ�Ӹ���֮��Ϊ_____________��

��5��ʯī������������Ҫԭ����__________________________��
��6�������Ľṹ�����ڽ��ʯ����֪���������������ԭ��֮��ľ���Ϊa cm����辧����ܶ�Ϊ_____________g��cm-3���ú���a�Ĵ���ʽ��ʾ����NA��ʾ����٤������ֵ����
���𰸡� 5p 3 ԭ�Ӿ��� As>Se>Ge sp 1��1 4 2��1 ʯī�������Ƭ��ṹ��Ƭ��֮�俿���ķ��»�����ϣ����Ի��� ![]()
����������1��Sn�ǵ������ڵ���AԪ�أ����̬Snԭ���У��������ռ�ݵ�����ܼ�����Ϊ5p�����ܼ����е�ԭ�ӹ����Ϊ3����2��Ge�������о�����ͽṹ�����Ge�����ľ�������Ϊԭ�Ӿ��塣ͬ�����������ҵ�һ����������������As��5p������Ӵ��ڰ����״̬���ȶ���ǿ����Ge��ͬ���ڵ� As��Se��Ƚϣ���һ�������ɴ�С��˳����As>Se>Ge����3�������в�����״�ṹ��ÿ��ԭ�Ӿ�����8�����ȶ��ṹ�����C2O2�ĽṹʽΪO=C=C=O����̼ԭ�ӵ��ӻ���ʽΪsp��˫������1��������1��������ɣ���˷����������������ĸ�����Ϊ1:1����4������̼����ľ���ṹ���ж�1��̼���辧����ռ8��1/8+6��1/2=4��̼ԭ�ӣ��������辧������С�Ļ���12��ԭ�ӣ�����ÿ����ԭ�ӱ�12�������У����ÿ����ֻռ�иù�ԭ�ӵ�1/12����Ϊÿ����С������6����ԭ�ӣ�����ÿ����С��ƽ��ӵ�еĹ�ԭ����Ϊ6��1/12=0.5��������ΪSiO2�������ɹ�ԭ�Ӻ���ԭ�Ӱ�1��2�ı�������ɣ����ÿ����С��ƽ��ӵ�е���ԭ�ӵ���ĿΪ0.5��2=1�������Զ������辧������С���ϵ�ԭ�Ӹ���֮��Ϊ2:1����5������ʯī�������Ƭ��ṹ��Ƭ��֮�俿���ķ��»�����ϣ����Ի���������ʯī����������6��������Si����=8��1/8+6��1/2+4=8���ʾ�������Ϊ8��28/NAg���辧����ܶ�Ϊ��gcm-3�����ⳤ=  �����Խ��߳���Ϊ
�����Խ��߳���Ϊ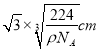 ���������������ԭ��֮��ľ���Ϊ
���������������ԭ��֮��ľ���Ϊ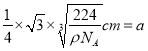 �����
�����![]() g��cm-3��
g��cm-3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Sb)����Ȼ��һ�����������ʽ���ڣ��ҹ�����̲���ռ�����һ������������ȡ������һ�������ڸ����½�����ת��Ϊ���������̼��ԭ����2Sb2S3��3O2��6Fe![]() Sb4O6��6FeS����Sb4O6��6C
Sb4O6��6FeS����Sb4O6��6C![]() 4Sb��6CO��������˵����ȷ����
4Sb��6CO��������˵����ȷ����
A����Ӧ��˵��������Sb��ԭ�Ա�Cǿ
B����Ӧ�٢����������ֱ���Sb2S3��Sb4O6
C��ÿ����1 mol Sbʱ����Ӧ���뷴Ӧ���л�ԭ�������ʵ���֮��Ϊ4�U3
D����Ӧ����ÿ����1 mol FeSʱ����ת��2 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���� 0.10 mol��L-1�İ�ˮ�ζ�10.0mL a mol L-1�����ᣬ��Һ��pH�백ˮ���(V)�Ĺ�ϵ��ͼ��ʾ����֪��N����Һ�д��ڣ�c(Cl-)=c(NH4+)+c(NH3��H2O)������˵������ȷ����
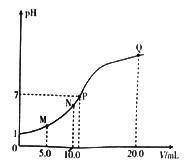
A. a=0.10
B. N��P������Һ��ˮ�ĵ���̶ȣ�N
C. M��N������Һ��NH4+�����ʵ���֮�ȴ���1��2
D. Q ����Һ�д��ڣ�2c(OH-)-2c(H+)=c(NH4+)-c(NH3��H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����13.6 g���������Ƭ�ܽ���25 mL��14 mol/L���ȵ�Ũ�����У�����ֻ��SO2�����Ϊ1.12 L����״����������Һϡ����100 mL��������Һ��KSCN��Һʱ��Ѫ��ɫ���֡����н�����ȷ����
A����Ӧ�У�ת�Ƶ���3.01��1022�� B����Ӧ��ʣ������0.30 mol
C��ԭ����n(Fe2O3)��n(Fe)=1��2 D��������Һ��c(FeSO4)=1.7 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������KMnO4����μ�Ũ��������������ɫ���壻����FeCl2��Һ��ͨ������ʵ�������������壬��Һ���ɫ����ȡʵ�������ɵ���Һ���ڵ���KI��ֽ�ϣ���ֽ����ɫ�������жϲ���ȷ����
A������ʵ��֤�������ԣ�MnO4����Cl2��Fe3+��I2
B��ʵ�����У���160 mL 10 mol/L�����������Һ������KMnO4��ַ�Ӧ����״���¿��Ƶ�11.2 L��Cl2
C��ʵ�������ɵ�������ʹʪ��ĵ���KI��ֽ����
D��ʵ������Ҫ�ռ���������Ļ���ɫ���壬Ӧ����������ͨ������ʳ��ˮ��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[2015���Ϻ�]��ҵ�Ͻ�Na2CO3��Na2S��1��2�����ʵ���֮�������Һ����ͨ��SO2������ȡNa2S2O3��ͬʱ�ų�CO2���ڸ÷�Ӧ��
A����Ԫ�ؼȱ������ֱ���ԭ
B���������뻹ԭ�������ʵ���֮��Ϊ1��2
C��ÿ����1 mol Na2S2O3��ת��4 mol����
D����ͬ�����£�ÿ����10 m3 SO2�ͻ�ų�2.5 m3 CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ����
A. ���³�ѹ�£�35.5g������������������������Һ��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.5NA
B. 60g��������������ǵĻ���ﺬ�е�̼ԭ����ĿΪ2NA
C. ��״���£�2.24L PH3��3.4gH2S�����������������Ŀ��Ϊ1.8NA
D. ��֪�ϳɰ���ӦN2(g)+3H2(g)![]() 2NH3(g) ��H= -92.4kJ/mol���÷�Ӧ����NA��NH3����ʱ����Ӧ�ų�������С��46.2kJ
2NH3(g) ��H= -92.4kJ/mol���÷�Ӧ����NA��NH3����ʱ����Ӧ�ų�������С��46.2kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ�������������������
A.���˲����У�©���ļ��Ӧ�Ӵ��ձ��ڱ�
B.������ƿ��ת��Һ��ʱ�������õIJ��������ԽӴ�����ƿ�ڱ�
C.����5%NaCl��Һʱ�������õ��IJ�������������ƿ���ձ�����ͷ�ιܡ�������
D.��Һ©��������ƿ���ζ���ʹ��ǰ�������©
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����Һ����Ҫ�ɷ�ΪNaCl��NaClO���ڿ�����������CO2�����ʣ���NaCl��NaClO�����������¿ɷ�����Ӧ��ClO- + Cl- + 2H+ = Cl2��+ H2O��ijѧϰС����̽��������Һ�ı��������
(1)ȡ��������Һ�����Թ��У���������һ��Ũ�ȵ����ᣬ������ų���ͨ������װ�ü�������ijɷֿ����ж�����Һ�Ƿ���ʡ�

ѧϰС���о�����Ϊ����������������֣��ף����ֱ��ʣ��ң�δ���ʣ�����______��
Ϊ����֤����Ϊ�ף����������ʵ�鷽������ѡ�Լ���
a.98%��Ũ���� b.1%��Ʒ����Һ c.1.0 mol��L-1��KI-������Һ
d.1.0 mol��L-1 ��NaOH��Һ e.����ʯ��ˮ f.����NaCl��Һ
�����Լ� | Ԥ������ͽ��� |
�Թ�A�м�����______(����ţ��� �Թ�B�м�1%Ʒ����Һ�� �Թ�C�м�______(�����)�� | ��A��________�� B��________�� C��________����׳����� |
(2)�õζ����ⶨ����Һ��NaClO��Ũ�ȡ�
����ʹ�õζ���֮ǰ���Ƚ��еIJ�����_____________________��
����ȡ25.00 mL����Һ������ƿ�У����������a mol��L-1 Na2SO3��Һv1 mL������Ӧ�Ļ�ѧ����ʽΪ��NaClO + Na2SO3 = NaCl+ Na2SO4����b mol��L-1���������ữ��KMnO4��Һװ��_________(����������)�У��ζ�ʣ���Na2SO3��Һ����Ӧ�Ļ�ѧ����ʽΪ��_______________������Һ��__________(��ζ��յ�����)ֹͣ�ζ�����¼���ݡ�
���ظ������ζ�����2�Σ�ƽ����������KMnO4��Һv2 mL��������Һ��NaClO��Ũ��Ϊ_______mol��L-1(�ú�a��b��v1��v2�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com