
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,易溶于水,遇酸易分解,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。工业制备Na2S2O3的反应为: S(s)+Na2SO3(aq)![]() Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。实验室拟用如下实验装置在C中制备Na2S2O3。
Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。实验室拟用如下实验装置在C中制备Na2S2O3。

请回答下列问题:
(1)按如图所示装置进行实验,装置A中反应的化学方程式是______________________。装置C中可观察到溶液先变浑浊,后又澄清,生成的浑浊物质化学式为___________。
(2)装置B的作用为_________;为保证Na2S2O3的产量,实验中通入的SO2不能过量,原因是_________。
(3)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下列装置进行实验:

①实验装置的连接顺序依次________________(填装置的字母代号),装置C中的试剂为____________。
②能证明固体中含有碳酸钠的实验现象是__________________。
(4)若要检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,再依次加入的试剂为_____________________和品红溶液。
【答案】
(1)Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;S;
(2)防止溶液倒吸;若SO2过量,溶液显酸性,产物会分解
(3)①ADCB;品红溶液;②装置C中品红溶液不褪色,B中澄清石灰水变浑浊
(4)氯化钡溶液、盐酸
【解析】
试题分析:(1)装置A中浓硫酸与亚硫酸钠反应生成二氧化硫,反应的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;二氧化硫能够与硫化钠在酸性溶液中发生氧化还原反应,生成硫单质,生成的硫有发生S(s)+Na2SO3(aq)![]() Na2S2O3(aq),因此装置C中可观察到溶液先变浑浊,后又澄清,故答案为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;S;
Na2S2O3(aq),因此装置C中可观察到溶液先变浑浊,后又澄清,故答案为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;S;
(2)装置B是安全瓶。可以防止溶液倒吸;根据题意,若SO2过量,溶液显酸性,产物Na2S2O3会分解,故答案为:防止溶液倒吸;若SO2过量,溶液显酸性,产物会分解;
(3)碳酸钠能够与酸反应生成二氧化碳,可以利用澄清石灰水检验,但由于混有二氧化硫,因此须用高锰酸钾溶液除去二氧化硫,并检验,实验装置的连接顺序依次为ADCB,装置C中的作用是检验二氧化硫是否除净,因此选用的试剂为品红溶液,故答案为:ADCB;品红溶液;
②能证明固体中含有碳酸钠的实验现象是装置C中品红溶液不褪色,B中澄清石灰水变浑浊,故答案为:装置C中品红溶液不褪色,B中澄清石灰水变浑浊;
(4)根据题意,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成,若要检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,再依次加入的试剂为氯化钡溶液、盐酸和品红溶液,若加入氯化钡溶液生成白色沉淀,过滤后,白色沉淀能够被盐酸溶解,放出的气体能够使品红溶液褪色,证明固体硫代硫酸钠工业产品中含有Na2SO3,故答案为:氯化钡溶液、盐酸。


科目:高中化学 来源: 题型:
【题目】为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:

将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。]
(1)装置Ⅰ中①中的化学方程式为______________________________________。
(2)装置Ⅰ中长导管的作用是__________________________。
(3)烧瓶中褐色油状液滴中有机物的成分是________,要想得到纯净的该产物,可用_________________洗涤。洗涤后分离粗产品应使用的仪器是___________________。
(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是__________________,b中的试剂是___________________。
比较两套装置,装置Ⅱ的主要优点是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有aXn+ 和bYm﹣两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
A.b﹣a=n+m
B.a﹣b=n﹣m
C.质子数Y>X
D.核电荷数Y<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是
A. 将燃油车改为燃气车有利于减少污染物排放
B. 含氟牙膏能有效预防龋齿,且其中所加氟化物的量宜多不宜少
C. 糖类、油脂及蛋白质都含有C、H、O元素
D. 酸雨浸蚀的土壤中加入熟石灰,可对该土壤进行修复
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是 (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
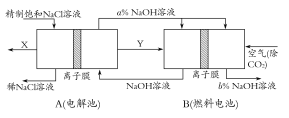
①图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应,正极: ;负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(O=C=S)广泛存在于以煤为原料制备的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染等。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7 kJ·mol-1
H2S(g)+CO(g) ΔH1=+7 kJ·mol-1
②水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35 kJ·mol-1
H2S(g)+CO2(g) ΔH2=-35 kJ·mol-1
请回答下列问题:
(1)已知热化学方程式:CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH3,则ΔH3 =_______。
H2(g)+CO2(g) ΔH3,则ΔH3 =_______。
(2)水解反应达到平衡后,若减小容器的体积,则逆反应速率_______________(填“增大”、“减小”或“不变”,下同),COS的转化率_______________。
(3)COS氢解反应的平衡常数K与温度T具有如下的关系式![]() (a、b均为常数)
(a、b均为常数)
①如图能表示COS的氢解反应的直线为____________。
②一定条件下,催化剂Ⅰ和Ⅱ对COS氢解反应的催化作用如下:
达到平衡所需时间/min | a 的数值 | b的数值 | |
催化剂Ⅰ | t | a1 | b1 |
催化剂Ⅱ | 2t | a2 | b2 |

则a1_______________a2 (填“>”、“<”、“=”)。
(4)某温度下,维持体系体积恒定,物质的量分别为m、n的COS蒸气和H2发生氢解反应。已知COS的平衡转化率为α,则在该温度下反应的平衡常数K=________(用m、n、α等符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作或叙述正确的是( )
① 医院用银氨溶液检验某病人是否患糖尿病
② 乙酸乙酯中的少量乙酸可用饱和![]() 溶液除去
溶液除去
③ 淀粉水解时应用浓硫酸作催化剂
④ 在鸡蛋白溶液中滴入浓![]() ,微热会产生黄色物质
,微热会产生黄色物质
⑤ 在植物油中滴入溴水,溴水褪色
⑥ 用盐析法可分离和提纯蛋白质
A.①②③④ B.②④⑤⑥
C.①③⑤⑥ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
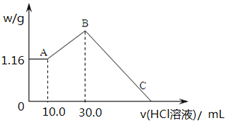
(1)A点的沉淀物的化学式为_________________。
(2)写出A点至B点发生反应的离子方程式:_____________________。
(3)某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为:______________,________________,________________。
(4)原混合物中NaOH的质量是________g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为_________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com