
【题目】联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)25 ℃,1.00 g N2H4 (l)与足量N2O4 (l)完全反应生成N2 (g)和H2O (l),放出19.14 kJ的热量。则反应2N2H4 (l)+N2O4 (l)=3N2 (g)+4H2O (l)的△H= __________ kJ/mol。
(2)已知:2NO2(g)![]() N2O4(g) △H=-57.20 kJ/mol。一定温度下,在密闭容器中反应2NO2(g)
N2O4(g) △H=-57.20 kJ/mol。一定温度下,在密闭容器中反应2NO2(g)![]() N2O4(g)达到平衡。
N2O4(g)达到平衡。
①其他条件不变时,下列措施能提高NO2转化率的是 ________。
A.升高温度 B.降低温度 C.增加NO2的浓度 D.扩大容器体积
②平衡时,c(NO2)=0.0300 mol/L、c(N2O4)=0.0120 mol/L。若升高温度,则平衡常数____________(填“增大”、“减小”或“不变”);若起始NO2和N2O4的浓度均为0.0100 mol/L,则v(正)______v(逆)(填“>”“<”或“=”)。
【答案】-1224.96BC减小<
【解析】
(1)由1.00 g N2H4 (l)反应放出的热求出2molN2H4 (l)反应放出的热,再书写热化学方程式;
(2)①该反应是反应前后气体体积减小的、放热的可逆反应,要提高二氧化氮的转化率,只要改变条件使化学平衡向正反应方向移动即可;
②化学平衡常数K=![]() ,化学平衡常数只与温度有关,与物质的浓度无关。
,化学平衡常数只与温度有关,与物质的浓度无关。
(1)由反应方程式:2N2H4 (l)+N2O4 (l)=3N2 (g)+4H2O (l) Q
2![]() 32g x
32g x
1.00g 19.14kJ
![]() =
=![]() ,解得x=1224.96kJ,
,解得x=1224.96kJ,
则反应2N2H4 (l)+N2O4 (l)=3N2 (g)+4H2O (l)的△H=-1224.96 kJ/mol,
因此,本题正确答案是:-1224.96;
(2)①该反应是反应前后气体体积减小的、放热的可逆反应,要使该反应向正反应方向移动,可改变反应物的浓度、体系的压强、温度等。
A、升高温度,平衡向逆反应方向移动,NO2的转化率降低,故A错误;
B、降低温度,平衡向正反应方向移动,NO2的转化率增大,故B正确;
C、增加NO2的浓度,平衡向正反应方向移动,NO2的转化率增大,故C正确;
D. 扩大容器体积,压强减小,平衡向逆反应方向移动,NO2的转化率降低,故D错误;
因此,本题正确答案是:BC;
② c(NO2)=0.0300 mol/L、c(N2O4)=0.0120 mol/L ;K=![]() =
=![]() =13.3,
=13.3,
若升高体系温度,平衡向逆反应方向移动,c(NO2)增大,则平衡常数K减小,
若起始NO2和N2O4的浓度均为0.0100 mol/L,则浓度商Qc=![]() =100>13.3=K,平衡逆向移动,此时v(正)<v(逆),
=100>13.3=K,平衡逆向移动,此时v(正)<v(逆),
因此,本题正确答案是:减小;<。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min
D. 当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质,相关说法正确的是
A. 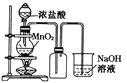 如果MnO2过量,浓盐酸就可全部被消耗
如果MnO2过量,浓盐酸就可全部被消耗
B. 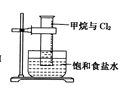 量筒中发生了取代反应
量筒中发生了取代反应
C. 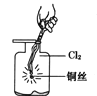 生成蓝色的烟
生成蓝色的烟
D. 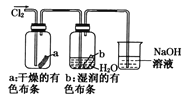 湿润的有色布条褪色说明了Cl2具有漂白性
湿润的有色布条褪色说明了Cl2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.H+、Fe2+、SO42-、NO3-B.Fe3+、NH4+、Cl-、SCN-
C.NH4+、Al3+、OH-、SO42-D.Na+、K+、NO3-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能源或能量转化的说法不正确的是
A.阳光、风力、流水、潮汐均属于能源
B.沼气、乙醇、氢气均是可再生能源
C.太阳能电池是将化学能转化为电能
D.氢气、太阳能、地热能均是绿色能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g)△H>0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
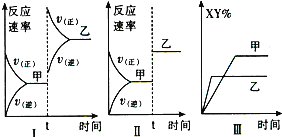
A. 图I是升高温度的变化情况
B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是增大压强的变化情况
D. 图Ⅲ是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列状态的氯中,电离最外层一个电子所需能量最大的是( )
A.[Ne]3s1B.[Ne]3s23p5C.[Ne]3s23p3D.[Ne]3s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中,正确的是
A. 一定温度下,向0.1mol/L的氨水中滴加相同浓度的醋酸,c(NH4+)/c(NH3·H2O) 减小
B. 已知Ksp(BaSO4) = 1.1×10—10, Ksp(BaCO3) = 2.58×10—9,所以不能将BaSO4转化为BaCO3
C. 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂
D. 配制FeCl3溶液时,为了抑制水解,可加入少量盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com