
【题目】短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示:

请回答下列问题:
(1)D在元素周期表中的位置为___。
(2)A和C形成的一种摩尔质量为41g·mol-1的化合物,该化合物与盐酸反应能生成两种盐,其化学方程式为___。
(3)M为A的简单气态氮化物,其水溶液可作刻蚀剂H2O2的清除剂,反应的产物不污染环境,其化学方程式为___。N为A的另一种氢化物,其相对分子质量比M大15,N为二元弱碱,在水中分步电离,并与M的电离方式相似,则N第一步电离的电离方程式为___,N与过量硫酸反应生成的酸式盐的化学式为___。
(4)下列事实能说明E元素的非金属性比D元素的非金属性强的是___ (填序号)。
①E的单质与D的气态氢化物的水溶液反应,生成淡黄色沉淀
②E与H2化合比D与H2化合更容易
③D与Fe化合时产物中Fe为+2价,E与Fe化合时产物中Fe为+3价
④等浓度的D和E的最高价含氧酸的水溶液中的c(H+):D>E
(5)D2E2分子中各原子最外层均满足8电子结构,则D2E2的电子式为___。
【答案】第三周期ⅥA族 AlN+4HCl=AlCl3+NH4Cl 2NH3+3H2O2=N2↑+6H2O或2NH3·H2O+3H2O2=N2↑+8H2O N2H4+H2O![]() N2H5++OH- N2H6(HSO4)2 ①②③
N2H5++OH- N2H6(HSO4)2 ①②③ ![]()
【解析】
由短周期元素A、B、C、D、E在元素周期表中的相对位置可知,A为N,B为O,C为Al,D为S,E为Cl。
A为N,B为O,C为Al,D为S,E为Cl。
(1)D为S,原子序数为16,位于周期表中的第三周期ⅥA族;
(2)A和C形成的一种摩尔质量为41g·mol-1的化合物,则该化合物为AlN。根据原子守恒,这两种盐分别为AlCl3和NH4Cl,其化学方程式为AlN+4HCl=AlCl3+NH4Cl;
(3)M为A的简单气态氢化物,为NH3,其水溶液为NH3·H2O,可作刻蚀剂H2O2的清除剂,反应的产物不污染环境,其化学方程式为2NH3+3H2O2=N2+6H2O;N为A的另一种氢化物,其相对分子质量比M大15,则N为N2H4。N为二元弱碱,在水中分步电离,并与M的电离方式相似,则N第一步电离的电离方程式为N2H4+H2O![]() N2H5++OH-;N2H4作为二元弱碱,其阳离子为N2H62+,与过量硫酸反应生成的酸式盐为硫酸氢盐,阴离子为HSO4-,化学式为N2H6(HSO4)2;
N2H5++OH-;N2H4作为二元弱碱,其阳离子为N2H62+,与过量硫酸反应生成的酸式盐为硫酸氢盐,阴离子为HSO4-,化学式为N2H6(HSO4)2;
(4)①E的单质,即Cl2,与D的气态氢化物H2S的水溶液反应,生成淡黄色沉淀,发生反应Cl2+H2S=S↓+2HCl,Cl2置换出S,Cl2的氧化性大于S的氧化性,则可知非金属性Cl(E)大于S(D),正确;
②非金属元素的非金属性越强,与氢气化合越容易。Cl2与H2化合比S与H2化合更容易,可知非金属性Cl(E)大于S(D),正确;
③S与Fe化合时产物中Fe为+2价,Cl2与Fe化合时产物中Fe为+3价,Cl2得到电子能力强,可知非金属性Cl(E)大于S(D),正确;
④D的最高价含氧酸为H2SO4,E的最高价含氧酸为HClO4。同浓度下,H2SO4溶液中c(H+)大,是由于H2SO4为二元酸,HClO4为一元酸,且均为强酸,在溶液中完全电离,与它们的非金属性强弱无关,错误;
综上①②③符合题意;
(5)D2E2分子中各原子最外层均满足8电子结构,S达到稳定结构需要形成2对共用电子对,Cl达到稳定结构需要形成1对共用电子对,可知S2Cl2分子中S原子间共用1对电子,每个S原子与Cl原子共用一对电子,结构式为Cl-S-S-Cl,其电子式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】某化合物与Cu+结合形成如图所示的离子,则下列说法错误的是( )
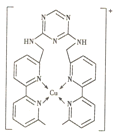
A.Cu+的核外电子排布式为[Ar]3d9
B.该离子中含有极性键、非极性键和配位键
C.该离子中碳原子的杂化方式有sp2、sp3两种
D.该离子中无手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代方士、道家炼制外丹常用的八种石质原料(即“八石”)为朱砂(HgS)、雄黄(As4S4)、雌黄(As2S3)、空青[Cu2(OH)2CO3]、云母[KAl2(AlSi3O10)(OH)x]、硫黄、戎盐(NaC1)、硝石(KNO3)(括号内为主要成分的化学式)。下列说法正确的是( )
A.雄黄、雌黄、硫黄的主要成分均为含硫化合物
B.空青、戎盐、硝石的主要成分均易溶于水
C.云母主要成分的化学式中x的值为2
D.朱砂与O2能发生反应:2HgS+3O2![]() 2HgO+2SO2,该反应属于置换反应
2HgO+2SO2,该反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:某温度下,铁的难溶化合物FeS在溶液中存在溶解平衡FeS(s)Fe2+ (aq) + S2-(aq),FeS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
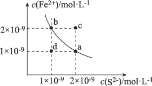
A.a点对应的Ksp(FeS)等于b点对应的Ksp(FeS)
B.c、d两点有沉淀析出的是c点
C.向d点溶液中加入FeCl3溶液,溶液中的离子浓度可实现由d点到b点的变化
D.该温度下,Ksp (FeS) =2×10-18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。下列说法正确的是

A.温度:a>b>c
B.仅升高温度,可从a点变为c点
C.水的离子积常数Kw:b>c>d
D.b点对应温度下,0.5 mol/L H2SO4溶液与1mol/L KOH溶液等体积混合,充分反应后,所得溶液中c(H+) = 1.0×10-7 mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的含氧酸有磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)等多种,它们在工业上都是重要的化工原料。
(1)亚磷酸(H3PO3)是一种二元弱酸,写出H3PO3与过量NaOH溶液反应的化学方程式:_______。某温度下,0.01 mol L-1 H3PO3溶液的pH为2.7,该温度下,H3PO3 的一级电离常数 Kal=_______。 (已知:lg2 = 0.3,lg3 = 0.5,lg5 = 0.7,H3PO3 的第二步电离忽略不计)
(2)某实验小组用NaOH溶液处理含H3PO3废水,当溶液中c (Na+) =c(H2PO3-) + 2c(HPO32-)时,溶液呈______性(填“酸”“碱”或“中”)。
(3)已知:常温下,磷酸(H3PO4)的 Kal=7.ll×10-3、Ka2 = 6.23×10-8、Ka3 = 4.5 ×10-13, 则常温下,Na2HPO4溶液中H2PO4-、HPO42-和PO43-的浓度由大到小的顺序为________。
(4)向某浓度的磷酸溶液中滴加NaOH溶液,其pH与溶液中H3PO4、H2PO4-、HPO42-和PO43-的物质的量分数为δ (平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_________。
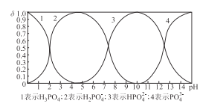
(5)已知:常温下,Ksp(FePO4) = l.3×10-22、Ksp(A1PO4) = 5.2 ×10-19。常温下,向含Fe3+、A13+的混合溶液中滴加Na3PO4溶液,当FePO4、AlPO4同时生成时,溶液中c(Fe3+):c(Al3+ ) =_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用乙酸浸泡水壶中的水垢,可将其清除 | 乙酸的酸性小于碳酸 |
B | 将MgCl2溶液加热蒸干,得到白色固体 | 固体为MgCl2 |
C | 向某溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀 | 原溶液中有Fe2+ |
D | 向盛有1 mL 2 mol/L NaOH溶液的试管中滴入几滴0.1 mol/L MgCl2溶液,有白色沉淀生成;再加入几滴0.1 mol/L FeCl3溶液,有红褐色沉淀生成 | Ksp[Mg(OH)2] >Ksp[Fe(OH)3] |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如图:
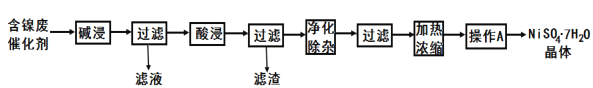
回答下列问题:
(1)滤液中的阴离子为_____。
(2)“酸浸”所使用的酸为_____。
(3)“净化除杂”是为了除铁,需加入H2O2溶液,溶液变成棕黄色,发生反应的离子方程式为__;一段时间后。溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是__;然后调节pH就可使溶液中铁元素完全沉淀,若使其刚好沉淀完全(离子浓度为1.0×10-5mol/L),此时的pH=__(保留一位小数)
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)关于铁铝化合物的下列说法正确的是__(填序号)。
①配制FeCl3、AlCl3溶液时,均是先将固体FeCl3、AlCl3溶于较浓的盐酸,再用蒸馏水稀释到所需浓度
②FeCl2、FeCl3、Fe(OH)3均可以通过化合反应生成
③利用氯水和KSCN溶液可以检验FeCl3溶液中有无Fe2+
④加热蒸干Al2(SO4)3溶液残留固体的成分为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下物质的转化关系图,回答有关问题:
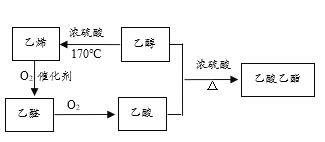
(1)上述物质中,_________(填结构简式,下同)的产量是衡量一个国家石油化工发展水平的标志;常见的酸性调味品中含有3%~5%的_________;具有香味的油状液体是_____________。
(2)乙醇中![]() 官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
(3)生成乙酸乙酯的化学方程式是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com