
【题目】已知:某温度下,铁的难溶化合物FeS在溶液中存在溶解平衡FeS(s)Fe2+ (aq) + S2-(aq),FeS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
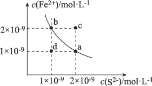
A.a点对应的Ksp(FeS)等于b点对应的Ksp(FeS)
B.c、d两点有沉淀析出的是c点
C.向d点溶液中加入FeCl3溶液,溶液中的离子浓度可实现由d点到b点的变化
D.该温度下,Ksp (FeS) =2×10-18
【答案】C
【解析】
根据FeS(s)Fe2+ (aq) + S2-(aq),可知Ksp(FeS)=c(Fe2+)·c(S2-),结合图像,FeS在水中的沉淀溶解平衡曲线的解析式为Ksp(FeS)=c(Fe2+)·c(S2-)。
A.结合Ksp(FeS)c(Fe2+)·c(S2-),a点和b点在同一曲线上,因而a点对应的Ksp(FeS)等于b点对应的Ksp(FeS),A项正确;
B.取a点带入Ksp(FeS)=c(Fe2+)·c(S2-),则Ksp(FeS)=1×10-9×2×10-9=2×10-18,Qc(c)=2×10-9×2×10-9=4×10-18> Ksp(FeS),Qc(d)=1×10-9×1×10-9=1×10-18<Ksp(FeS),则c、d两点有沉淀析出的是c点,B项正确;
C.向d点溶液中加入FeCl3溶液,Fe3+与S2-发生反应,S2-浓度减小,而d点到b点S2-浓度不发生改变,矛盾,C项错误;
D.见B项,该温度下,Ksp (FeS) =2×10-18,D项正确;
故选C。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】高分子化合物PA66的合成路线如下:
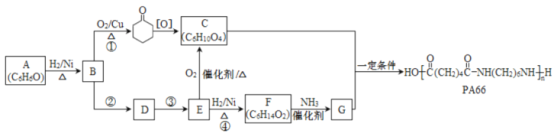
已知: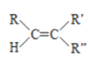
![]() RCHO+
RCHO+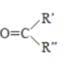
(1)A属于芳香化合物,其结构简式是____________。
(2)①的化学方程式是______________。
(3)D的结构简式是________________。
(4)④的化学方程式是______________。
(5)反应①~④中属于氧化反应的是____________(填序号)。
(6)C和G生成PA66的化学方程式是_____________。
(7)![]() 有多种同分异构体,符合下列条件的有_________种,其中任意一种同分异构体的结构简式是________。
有多种同分异构体,符合下列条件的有_________种,其中任意一种同分异构体的结构简式是________。
i. 为链状化合物且无支链; ii. 为反式结构; iii. 能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废钯催化剂中含钯 5-6%,碳 93-94%,铁 1-2%,铜 0.1-0.2%以及锌等杂质。在实验室中探究采用废钯催化剂制备无水氯化钯,具体流程如下:
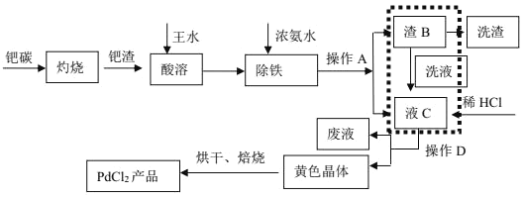
已知:Pd2+、Cu2+、Zn2+等离子均可与氨水生成[M(NH3)n]x+离子,其中[Pd(NH3)2]2+在盐酸中能以[Pd(NH3)2]Cl2 黄色晶体的形式析出。
(1)灼烧钯碳时使用的主要仪器有:酒精灯、玻璃棒、_____(支持仪器省略)。王水溶解过程中会生成 NOCl,NOCl 的结构式为________。
(2)是否进行虚线方框内的操作,对提高钯的回收率至关重要,其主要原因是_____。
(3)最后焙烧之前若不烘干,所得产品中会混有_____杂质。
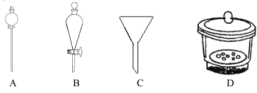
(4)可用“化学放大”法测定样品中的微量 Fe3+:在酸性介质中加入过量的 KI 后用CCl4萃取,分去水相后,用肼(N2H4)的水溶液进行还原并反萃取,还原过程中有无污染的气体生成。再用过量的 Br- 将反萃取出的 I- 氧化成 IO3- ,煮沸除 Br2后,加入过量的 KI,酸化后用Na2S2O3 标准液进行滴定。经上述步骤后,样品含量的测定值放大了_____倍,写出还原过程中发生反应的离子方程式___________,假定萃取达到平衡时,样品在水和萃取剂中的总浓度比为 1∶80,50mL 的水溶液样品,用 10mL 萃取剂萃取,萃取后溶液中残留的样品浓度为原溶液的_______________倍(用分数表示)。完成萃取和反萃取操作,必须选用的仪器有____________(填标号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过下列装置(部分夹持仪器已省略)可制取1,2-二溴乙烷。下列说法正确的是( )
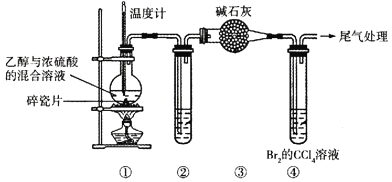
已知:烧瓶中反应后逸出的气体主要是CH2=CH2,含少量SO2、CO2及H2O(g)。
A.配制“乙醇与浓硫酸的混合溶液”时,将乙醇注入浓硫酸中并搅拌
B.②的试管中可盛放酸性KMnO4溶液以除去SO2
C.④中的Br2已完全与乙烯加成的现象是:溶液由橙色变为无色
D.可用分液漏斗从④反应后的混合物中分离出1,2-二溴乙烷并回收CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物M是一种治疗恶性肿瘤的合成药物。制备M的一种合成路线如图所示:

已知:  (R为烃基)。
(R为烃基)。
(1)A的化学名称是________。
(2)由A生成B和B生成C的反应类型分别是_________、________。
(3)由C生成D的化学方程式是____________________。
(4)写出E的结构简式:________,X是E的同分异构体,且X满足下列条件:
①能发生银镜反应;②遇浓FeCl3溶液变色;③分子结构中只含一个碳环结构。
符合上述条件的X有_____种,其中核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为2:2:2:1:1的结构简式是_____________。
(5)根据题给信息,写出用CH3CHO和 为原料制备
为原料制备 的合成路线:_________________(其他试剂任选)。
的合成路线:_________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾离子电池资源丰富,在非水基电解液中具有更高的离子导电率等优点。一种钾离子电池的工作原理如图所示,已知该电池负极在KC24-KC16-KC8之间变化,正极在K2MnFe(CN)6-KMnFe(CN)6-MnFe(CN)6之间变化,下列说法不正确的是( )
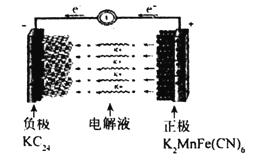
A.如图所示为钾离子电池的放电过程
B.放电时负极可发生反应:2KC8-e-=KC16+K+
C.充电时正极反应式为K2MnFe(CN)6-e-=KMnFe(CN)6+K+
D.若充电前正负极质量相同,则充电时每转移0.lmole-,理论上正负极质量差将增加7.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示:

请回答下列问题:
(1)D在元素周期表中的位置为___。
(2)A和C形成的一种摩尔质量为41g·mol-1的化合物,该化合物与盐酸反应能生成两种盐,其化学方程式为___。
(3)M为A的简单气态氮化物,其水溶液可作刻蚀剂H2O2的清除剂,反应的产物不污染环境,其化学方程式为___。N为A的另一种氢化物,其相对分子质量比M大15,N为二元弱碱,在水中分步电离,并与M的电离方式相似,则N第一步电离的电离方程式为___,N与过量硫酸反应生成的酸式盐的化学式为___。
(4)下列事实能说明E元素的非金属性比D元素的非金属性强的是___ (填序号)。
①E的单质与D的气态氢化物的水溶液反应,生成淡黄色沉淀
②E与H2化合比D与H2化合更容易
③D与Fe化合时产物中Fe为+2价,E与Fe化合时产物中Fe为+3价
④等浓度的D和E的最高价含氧酸的水溶液中的c(H+):D>E
(5)D2E2分子中各原子最外层均满足8电子结构,则D2E2的电子式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B. 2 g由H218O和2H2O组成的物质中含有的质子数为NA
C. 8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 H 是优良的溶剂,在工业上可用作洗涤剂、润滑剂,其合成线路:

已知:①![]() ;
;
② ![]()
③
请回答下列问题:
(1)H 的名称为_______________。A 的结构简式为 ______________________________ 。
(2)C→D 所需试剂及反应条件分别为_______、________。
(3)D→E 的化学方程式为____________________________________________________。
(4)F 中含有官能团的名称为_________________ 。G→H 的反应类型为______________________。
(5)符合下列条件的 F 的同分异构体的结构简式为 _______________________________________ 。
①能与 NaHCO3 溶液反应放出 CO2 ② 能发生银镜反应 ③ 核磁共振氢谱有 4 组峰且峰面积之比为 9:1:1:1;
(6)请设计由![]() 和乙烯(CH2=CH2)为起始原料,制备
和乙烯(CH2=CH2)为起始原料,制备![]() 的合成路线_______________________________________ (无机试剂任选)。
的合成路线_______________________________________ (无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com