
【题目】有机物 H 是优良的溶剂,在工业上可用作洗涤剂、润滑剂,其合成线路:

已知:①![]() ;
;
② ![]()
③
请回答下列问题:
(1)H 的名称为_______________。A 的结构简式为 ______________________________ 。
(2)C→D 所需试剂及反应条件分别为_______、________。
(3)D→E 的化学方程式为____________________________________________________。
(4)F 中含有官能团的名称为_________________ 。G→H 的反应类型为______________________。
(5)符合下列条件的 F 的同分异构体的结构简式为 _______________________________________ 。
①能与 NaHCO3 溶液反应放出 CO2 ② 能发生银镜反应 ③ 核磁共振氢谱有 4 组峰且峰面积之比为 9:1:1:1;
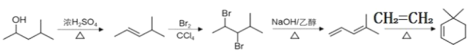
(6)请设计由![]() 和乙烯(CH2=CH2)为起始原料,制备
和乙烯(CH2=CH2)为起始原料,制备![]() 的合成路线_______________________________________ (无机试剂任选)。
的合成路线_______________________________________ (无机试剂任选)。
【答案】4-甲基-2-戊醇 ![]() 乙醇 浓硫酸、加热
乙醇 浓硫酸、加热 ![]() 羧基和羰基 加成反应
羧基和羰基 加成反应 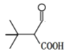 或
或![]()
【解析】
A和乙炔反应生成B,再根据信息①得到A的结构为![]() ,B与高锰酸钾反应,再根据信息②得到C的结构CH3COCH2COOH,C与乙醇在浓硫酸作用下反应生成D,D与
,B与高锰酸钾反应,再根据信息②得到C的结构CH3COCH2COOH,C与乙醇在浓硫酸作用下反应生成D,D与![]() 发生取代反应生成E,E发生水解反应生成F,F根据信息③得到G(
发生取代反应生成E,E发生水解反应生成F,F根据信息③得到G(![]() ),G再与氢气发生加成反应。
),G再与氢气发生加成反应。
⑴根据H的结构,得到H的名称为4-甲基-2-戊醇,根据A和乙炔反应生成B,和信息①得到A的结构简式为![]() ;故答案为:4-甲基-2-戊醇;
;故答案为:4-甲基-2-戊醇;![]() 。
。
⑵C→D发生酯化反应,因此所需试剂及反应条件分别为乙醇、浓硫酸、加热;故答案为:乙醇;浓硫酸、加热。
⑶D→E的化学方程式为![]() ;故答案为:
;故答案为:![]() 。
。
⑷根据F的结构得到F中含有官能团的名称为羧基和羰基,G→H的反应类型为加成反应;故答案为:羧基和羰基;加成反应。
⑸①能与NaHCO3 溶液反应放出CO2说明含有羧基,②能发生银镜反应说明含有醛基,③核磁共振氢谱有4组峰且峰面积之比为 9:1:1:1,符合条件的F的同分异构体的结构简式为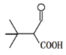 ;故答案为:
;故答案为: 或
或![]() 。
。
⑹![]() 在浓硫酸作用下发生下去反应得到
在浓硫酸作用下发生下去反应得到![]() ,
,![]() 与溴发生加成反应得到
与溴发生加成反应得到![]() ,
,![]() 在氢氧化钠乙醇作用下发生消去反应
在氢氧化钠乙醇作用下发生消去反应![]() ,
,![]() 和乙烯发生加成反应得到
和乙烯发生加成反应得到![]() ,因此由
,因此由![]() 和乙烯(CH2=CH2)为起始原料,制备
和乙烯(CH2=CH2)为起始原料,制备![]() 的合成路线
的合成路线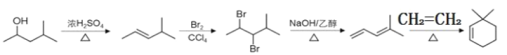 ;故答案为:
;故答案为: 。
。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】已知:某温度下,铁的难溶化合物FeS在溶液中存在溶解平衡FeS(s)Fe2+ (aq) + S2-(aq),FeS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
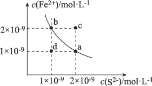
A.a点对应的Ksp(FeS)等于b点对应的Ksp(FeS)
B.c、d两点有沉淀析出的是c点
C.向d点溶液中加入FeCl3溶液,溶液中的离子浓度可实现由d点到b点的变化
D.该温度下,Ksp (FeS) =2×10-18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如图:
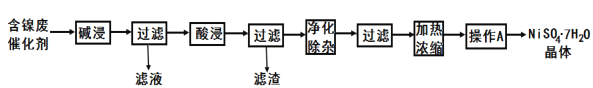
回答下列问题:
(1)滤液中的阴离子为_____。
(2)“酸浸”所使用的酸为_____。
(3)“净化除杂”是为了除铁,需加入H2O2溶液,溶液变成棕黄色,发生反应的离子方程式为__;一段时间后。溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是__;然后调节pH就可使溶液中铁元素完全沉淀,若使其刚好沉淀完全(离子浓度为1.0×10-5mol/L),此时的pH=__(保留一位小数)
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)关于铁铝化合物的下列说法正确的是__(填序号)。
①配制FeCl3、AlCl3溶液时,均是先将固体FeCl3、AlCl3溶于较浓的盐酸,再用蒸馏水稀释到所需浓度
②FeCl2、FeCl3、Fe(OH)3均可以通过化合反应生成
③利用氯水和KSCN溶液可以检验FeCl3溶液中有无Fe2+
④加热蒸干Al2(SO4)3溶液残留固体的成分为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的X加入某密闭容器中,发生反应:2X(g)![]() 3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断不正确的是( )
3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断不正确的是( )

A.升高温度,该反应平衡常数K增大
B.压强大小有P3>P2>P1
C.反应过程中加入高效催化剂可以缩短达到平衡的时间
D.在该条件下M点X平衡转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化合物SOCl2是一种液态化合物,沸点为77℃,在盛有10mL水的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
①根据上述实验,写出SOCl2和水反应的化学方程式____。
②AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,其原因是____。
(2)25℃时,将amol/L氨水与0.01mol/L盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显__(填“酸”、“碱”或“中”)性。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中![]() __。
__。
[已知Ksp(BaCO3)=2.2×10–9,Ksp(BaSO4)=1.1×10–10]。
(4)次磷酸(H3PO2)是一种精细化工产品。常温下,K(H3PO2)=1×10–2,0.1mol/L的H3PO2溶液在加水稀释过程中,下列表达式的数据一定变小的是_。(填序号)
A.c(H+) B.![]() C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用。SPFS可表示成Fex(OH)y(SO4)z·nH2O。工业上常用的一种制备流程为:(绿矾化学式为FeSO4·7H2O)
![]()
在SPFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=n(OH-)/3n( Fe) ×100%。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH一和Fe的物质的量。试回答下列问题。
(1)在绿矾中加人酸性介质的NaClO3目的是__________ 。
(2)SPFS溶于水后并与水反应生成__________ 能吸附水中的悬浮物来净化水。
(3)取15.05g某固体聚合硫酸铁溶解于水,向其中加人过量的BaCI2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀20.97g.向上述滤液中加人NH3H2O,调节溶液pH= 6,经过滤、洗涤、干燥得Fe2O3固体5.60g。该固体聚合硫酸铁的盐基度为_________ 。
(4)计算出该固体聚合硫酸铁样品的化学式______________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下物质的转化关系图,回答有关问题:
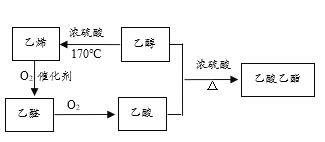
(1)上述物质中,_________(填结构简式,下同)的产量是衡量一个国家石油化工发展水平的标志;常见的酸性调味品中含有3%~5%的_________;具有香味的油状液体是_____________。
(2)乙醇中![]() 官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
(3)生成乙酸乙酯的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠是一种多用途的新型漂白剂,化学式可表示为aNa2CO3·bH2O2,过碳酸钠溶于水分解成Na2CO3和H2O2。
(1)FeOCl常用作过碳酸钠使用时的催化剂。FeCl3·6H2O在250℃时分解可得到FeOCl,该反应的化学方程式为______________________________________。
(2)测定某样品中过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
步骤Ⅰ:称取样品0.800 0 g于锥形瓶中,加水溶解,滴加甲基橙作指示剂,用0.200 0 mol·L-1H2SO4溶液滴定至终点,消耗硫酸25.00 mL。
步骤Ⅱ:另称取样品0.800 0 g于锥形瓶中,加水溶解,加稀硫酸酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至终点(滴定过程中MnO被还原为Mn2+),消耗KMnO4溶液30.00 mL。
①步骤Ⅰ中,滴定终点的现象是____________________。
②步骤Ⅱ中,若样品溶于水酸化后放置一段时间,然后再进行滴定,则过碳酸钠化学式中a∶b的测定结果将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该过碳酸钠化学式(写出计算过程)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A.用K3[Fe(CN)6]检验Fe2+的离子反应方程式:2Fe(CN)63- + 3Fe2+= Fe3[Fe(CN)6]2 ↓
B.含氟牙膏防治龋齿的原理是氟离子会跟羟基磷灰石发生沉淀转化生成氟磷灰石的离子反应方程式:Ca5(PO4)3(OH) +F- ![]() Ca5(PO4)3F +OH -
Ca5(PO4)3F +OH -
C.用TiCl4制备TiO2的化学方程式:TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
D.已知在重铬酸钾溶液中存在着如下平衡:Cr2O72-+ H2O![]() H++ 2CrO42-
H++ 2CrO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com