
【题目】过碳酸钠是一种多用途的新型漂白剂,化学式可表示为aNa2CO3·bH2O2,过碳酸钠溶于水分解成Na2CO3和H2O2。
(1)FeOCl常用作过碳酸钠使用时的催化剂。FeCl3·6H2O在250℃时分解可得到FeOCl,该反应的化学方程式为______________________________________。
(2)测定某样品中过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
步骤Ⅰ:称取样品0.800 0 g于锥形瓶中,加水溶解,滴加甲基橙作指示剂,用0.200 0 mol·L-1H2SO4溶液滴定至终点,消耗硫酸25.00 mL。
步骤Ⅱ:另称取样品0.800 0 g于锥形瓶中,加水溶解,加稀硫酸酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至终点(滴定过程中MnO被还原为Mn2+),消耗KMnO4溶液30.00 mL。
①步骤Ⅰ中,滴定终点的现象是____________________。
②步骤Ⅱ中,若样品溶于水酸化后放置一段时间,然后再进行滴定,则过碳酸钠化学式中a∶b的测定结果将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该过碳酸钠化学式(写出计算过程)。___________
【答案】FeCl3·6H2O![]() FeOCl+2HCl↑+5H2O↑ 黄色变为橙色 偏大 2Na2CO3·3H2O2
FeOCl+2HCl↑+5H2O↑ 黄色变为橙色 偏大 2Na2CO3·3H2O2
【解析】
(1)FeCl3·6H2O在250℃时分解可得到FeOCl,根据物料守恒书写该反应的化学方程式;
(2)①步骤Ⅰ中,甲基橙作指示剂,终点时,甲基橙由黄色变为橙色;
②步骤Ⅱ中,KMnO4溶液滴定至终点用来测定样品中双氧水的含量,双氧水不稳定;
③根据步骤Ⅰ、Ⅱ分别计算出碳酸钠和双氧水的含量,进而计算确定该过碳酸钠化学式。
(1)FeCl3·6H2O在250℃时分解可得到FeOCl,根据物料守恒,该反应的化学方程式;FeCl3·6H2O![]() FeOCl+2HCl↑+5H2O↑;
FeOCl+2HCl↑+5H2O↑;
(2)①步骤Ⅰ中,甲基橙作指示剂,终点时,最后一滴硫酸过量,甲基橙由黄色变为橙色,滴定终点的现象是:加入最后一滴硫酸标准液,甲基橙由黄色变为橙色,且半分钟内不变色;
②步骤Ⅱ中,样品溶于过碳酸钠分解成Na2CO3和H2O2,酸化后放置一段时间双氧水会发生分解生成水,双氧水的含量减少,再用KMnO4溶液进行滴定时,与双氧水发生反应,消耗标准溶液的体积减小,导致测得的双氧水的量减小,即b减小,则过碳酸钠化学式中a∶b的测定结果将偏大;
③根据步骤Ⅰ,硫酸滴定样品溶液中的碳酸钠,反应为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,则n(Na2CO3)=n(H2SO4)= 0.200 0 mol·L-1×25.00 ×10-3L=0.005mol;
根据步骤Ⅱ,用高锰酸钾滴定溶液中的双氧水,测定其含量,离子反应为2MnO4ˉ+5H2O2+6H+=5O2↑+2Mn2++H2O,则n(H2O2)=![]() n(KMnO4)=
n(KMnO4)=![]() ×0.100 0 mol·L-1×30.00 ×10-3L=0.0075mol;则a∶b= n(Na2CO3):n(H2O2)=0.005:0.0075=2:3,则过碳酸钠化学式为2Na2CO3·3H2O2。
×0.100 0 mol·L-1×30.00 ×10-3L=0.0075mol;则a∶b= n(Na2CO3):n(H2O2)=0.005:0.0075=2:3,则过碳酸钠化学式为2Na2CO3·3H2O2。


 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B. 2 g由H218O和2H2O组成的物质中含有的质子数为NA
C. 8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 H 是优良的溶剂,在工业上可用作洗涤剂、润滑剂,其合成线路:

已知:①![]() ;
;
② ![]()
③
请回答下列问题:
(1)H 的名称为_______________。A 的结构简式为 ______________________________ 。
(2)C→D 所需试剂及反应条件分别为_______、________。
(3)D→E 的化学方程式为____________________________________________________。
(4)F 中含有官能团的名称为_________________ 。G→H 的反应类型为______________________。
(5)符合下列条件的 F 的同分异构体的结构简式为 _______________________________________ 。
①能与 NaHCO3 溶液反应放出 CO2 ② 能发生银镜反应 ③ 核磁共振氢谱有 4 组峰且峰面积之比为 9:1:1:1;
(6)请设计由![]() 和乙烯(CH2=CH2)为起始原料,制备
和乙烯(CH2=CH2)为起始原料,制备![]() 的合成路线_______________________________________ (无机试剂任选)。
的合成路线_______________________________________ (无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )
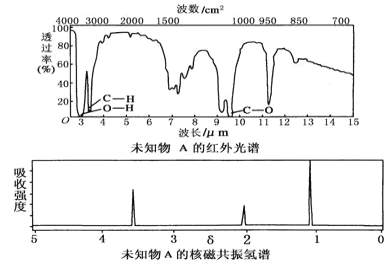
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )

A. 在NaCl晶体中,距Na+最近的Cl-有6个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成.下列装置是用燃烧法确定有机物分子式常用的装置.

(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是
(2)C装置中浓硫酸的作用是 .
(3)D装置中MnO2的作用是 .
(4)燃烧管中CuO的作用是 .
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为 .
(6)用质谱仪测定其相对分子质量,得如图二所示的质谱图,则该有机物的相对分子质量为 .
(7)能否根据A的实验式确定A的分子式 (填“能”或“不能”),若能,则A的分子式是 (若不能,则此空不填).
(8)该物质的核磁共振氢谱如图三所示,则其结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国矿石种类很多,如黄铜矿、煤、锰矿、锑锌矿等,请回答下列问题:
(l)黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),基态Cu2+的外围电子排布图为 ______,Fe2+含有 ___个未成对电子。
(2)Mn的第三电离能比Fe的第三电离能大的原因为 ___。
(3)煤化工可得氨气、苯、甲苯等产品,氨的空间构型为 ___,甲苯分子上甲基的碳原子的杂化方式为____;氨硼烷化合物(NH3BH3)是一种新型化学氢化物储氢材料,氨硼烷的结构式为____(配位键用“→”表示),与氨硼烷互为等电子体的有机小分子为_____写名称)。
(4)碲化锌的晶胞结构如图1所示。
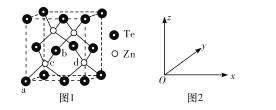
①碲化锌的化学式为____。
②图2可表示晶胞内部各原子的相对位置,已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),则d的原子坐标参数为____
),则d的原子坐标参数为____
③若两个距离最近的Te原子间距离为apm,阿伏加德罗常数值为NA,则晶体密度为____g/cm3(用含有NA、a的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)
NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)![]() 2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
(2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O)
化学键 | N≡O | Cl-Cl | Cl-N | N==O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
(3)300℃时,2NO(g)+Cl2 (g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/(mol·L-1) | v/(mol·L-1·s-l) |
① | 0. 30 | 3. 60×10-9 |
② | 0. 60 | 1. 44×10-8 |
③ | 0. 90 | 3. 24×10-8 |
n = ___;k = ____。
(4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g)![]() 2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
a.容器中的压强不变 b.2v正(NO) = v逆(Cl2)c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变
(5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g)![]() 2ClNO(g)△H。
2ClNO(g)△H。
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H __(填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图甲曲线b所示,则改变的条件是______。

②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”),m值为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法错误的是

A.法匹拉韦的分子式为C5H4N3O2F
B.法匹拉韦最多能与4 mol H2发生加成反应
C.法匹拉韦在一定条件下能与NaOH溶液发生反应
D.法匹拉韦能使酸性高锰酸钾溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com