
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)
NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)![]() 2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
(2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O)
化学键 | N≡O | Cl-Cl | Cl-N | N==O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
(3)300℃时,2NO(g)+Cl2 (g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/(mol·L-1) | v/(mol·L-1·s-l) |
① | 0. 30 | 3. 60×10-9 |
② | 0. 60 | 1. 44×10-8 |
③ | 0. 90 | 3. 24×10-8 |
n = ___;k = ____。
(4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g)![]() 2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
a.容器中的压强不变 b.2v正(NO) = v逆(Cl2)c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变
(5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g)![]() 2ClNO(g)△H。
2ClNO(g)△H。
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H __(填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图甲曲线b所示,则改变的条件是______。

②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”),m值为_____。

【答案】K3=![]() 289-2a 2 4. 0×10-8 L·mol-1·s-1 acd < 加入催化剂 乙 2
289-2a 2 4. 0×10-8 L·mol-1·s-1 acd < 加入催化剂 乙 2
【解析】
(1)利用方程式叠加关系得到平衡常数之间的关系;
(2)利用键能计算焓变,反应物的键能之和减去生成物的键能之和就是焓变;
(3)将表中数据带入速率方程即可求得n和k;
(4)平衡状态的判定;
(5)列三段式计算平衡常数,进而去计算。
(1)①![]() ②
②![]() 将①×2②可得:
将①×2②可得:![]() ,则平衡常数
,则平衡常数![]() ,
,
故答案为:![]() ;
;
(2)![]() 反应的△H=反应物的键能之和生成物的键能之和
反应的△H=反应物的键能之和生成物的键能之和![]() ,
,
故答案为:289-2a;
(3)根据表格①②中的数据,带入速率公式然后做比值:![]() ,解得n=2,将n代入①中得k=4×108,
,解得n=2,将n代入①中得k=4×108,
故答案为:2;4. 0×10-8 L·mol-1·s-1;
(4)a.对于反应![]() ,反应前后气体系数变化,故压强是变量,故当压强不再变化说明反应已经平衡,a正确;
,反应前后气体系数变化,故压强是变量,故当压强不再变化说明反应已经平衡,a正确;
b. 2v正(NO) = v逆(Cl2),正逆反应速率不相等,反应未达到平衡状态,b错误;
c. 气体的平均相对分子质量即平均摩尔质量等于总质量比总物质的量,总质量虽然不变,但是总物质的量会改变,故平均相对分子质量是变量,当它不再变化则说明反应已经达到平衡状态,c正确;
d. 绝热容器中,温度会改变,温度改变平衡常数就会改变,当平衡常数不再变化则说明反应已经达到平衡状态,d正确;
e.![]() 和
和![]() 的体积比始终是2:1,不是变量,故不能说明达到平衡状态,e错误;
的体积比始终是2:1,不是变量,故不能说明达到平衡状态,e错误;
答案选acd;
(5)①由图甲分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的,随反应进行温度升高,压强增大;反应到一定程度,因反应物浓度减小,随反应正向进行,压强反而减小,到压强随时间变化不变时,达到平衡状态,反应焓变为△H<0;由图甲知:化学反应速率加快,平衡不动,故改变的条件:加入催化剂;
答案为:<;加入催化剂;
②T升高,平衡左移,K减小,lgK减小,曲线选乙,设反应的氯气物质的量为x,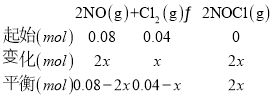 根据压强之比等于物质的量之比,得到:
根据压强之比等于物质的量之比,得到:![]() ,解得:x=0.02mol,依据计算得到平衡时物质的浓度代入x求得:
,解得:x=0.02mol,依据计算得到平衡时物质的浓度代入x求得:![]() ;
;![]() ;
;![]() ;
;
平衡常数: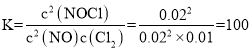 ,lgK=lg100=2,m=2;
,lgK=lg100=2,m=2;
故答案为:乙;2。


科目:高中化学 来源: 题型:
【题目】将一定量的X加入某密闭容器中,发生反应:2X(g)![]() 3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断不正确的是( )
3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断不正确的是( )

A.升高温度,该反应平衡常数K增大
B.压强大小有P3>P2>P1
C.反应过程中加入高效催化剂可以缩短达到平衡的时间
D.在该条件下M点X平衡转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠是一种多用途的新型漂白剂,化学式可表示为aNa2CO3·bH2O2,过碳酸钠溶于水分解成Na2CO3和H2O2。
(1)FeOCl常用作过碳酸钠使用时的催化剂。FeCl3·6H2O在250℃时分解可得到FeOCl,该反应的化学方程式为______________________________________。
(2)测定某样品中过碳酸钠化学式的实验步骤如下(样品中杂质不参加反应):
步骤Ⅰ:称取样品0.800 0 g于锥形瓶中,加水溶解,滴加甲基橙作指示剂,用0.200 0 mol·L-1H2SO4溶液滴定至终点,消耗硫酸25.00 mL。
步骤Ⅱ:另称取样品0.800 0 g于锥形瓶中,加水溶解,加稀硫酸酸化,用0.100 0 mol·L-1 KMnO4溶液滴定至终点(滴定过程中MnO被还原为Mn2+),消耗KMnO4溶液30.00 mL。
①步骤Ⅰ中,滴定终点的现象是____________________。
②步骤Ⅱ中,若样品溶于水酸化后放置一段时间,然后再进行滴定,则过碳酸钠化学式中a∶b的测定结果将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该过碳酸钠化学式(写出计算过程)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET(![]() ,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
A.PET塑料是一种可降解高分子材料
B.滴定终点时,溶液变为浅红色
C.合成PET的一种单体是乙醇的同系物
D.PET的平均聚合度![]() (忽略端基的摩尔质量)
(忽略端基的摩尔质量)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
C.![]() 的稳定性很强,是因为其分子间能形成氢键
的稳定性很强,是因为其分子间能形成氢键
D.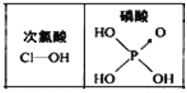 由图可知酸性:
由图可知酸性:![]() ,是因为
,是因为![]() 分子中有1个非羟基氧原子
分子中有1个非羟基氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬绿(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠(Na2CrO4)制备氧化铬绿的工艺流程如下:
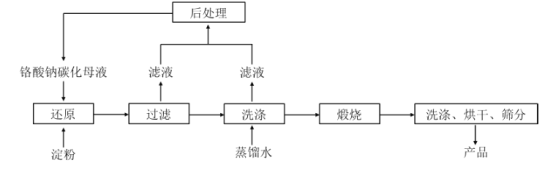
已知:①向含少量 Na2 CO3的铬酸钠碱性溶液中通入CO 2可制得不同碳化率的铬酸钠碳化母液;
②“还原”反应剧烈放热,可制得 Cr(OH) 3 浆料。
(1)铬酸钠(Na2CrO4)中铬元素的价态是________,该工艺中“还原”反应最初使用的是蔗糖或甲醛,请写出甲醛的电子式:________________,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式___________________________ 。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是____________(填标号)。
A.该反应一定无需加热即可进行 B.必要时可使用冷却水进行温度控制
C.铬酸钠可适当过量,使淀粉充分反应 D.应建造废水回收池,回收含铬废水
(3)测得反应完成后在不同恒温温度、不同碳化率下 Cr(Ⅵ)还原率如下图。实际生产过程中 Cr(Ⅵ)还原率可高达 99.5%以上,“还原”阶段采用的最佳反应条件为________________。
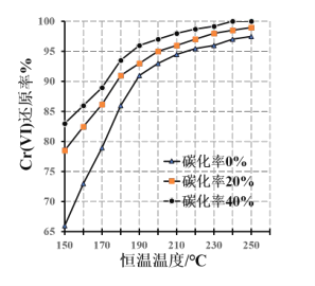
(4)滤液中所含溶质为_________________。该水热法制备氧化铬绿工艺的优点有________________ 、___(请写出两条)。
(5)重铬酸钠(Na2Cr2O7·H2O)与硫酸铵热分解法也是一种生产氧化铬绿的方法,生产过程中产生的气体对环境无害,其化学反应方程式为______________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A.用K3[Fe(CN)6]检验Fe2+的离子反应方程式:2Fe(CN)63- + 3Fe2+= Fe3[Fe(CN)6]2 ↓
B.含氟牙膏防治龋齿的原理是氟离子会跟羟基磷灰石发生沉淀转化生成氟磷灰石的离子反应方程式:Ca5(PO4)3(OH) +F- ![]() Ca5(PO4)3F +OH -
Ca5(PO4)3F +OH -
C.用TiCl4制备TiO2的化学方程式:TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
D.已知在重铬酸钾溶液中存在着如下平衡:Cr2O72-+ H2O![]() H++ 2CrO42-
H++ 2CrO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1 mol·L-1 KOH 溶液滴定 10 mL 0.1 mol·L-1 HA(Ka =1.0×10-5)溶液的滴定曲线如图所示。下列说法正确的是( )
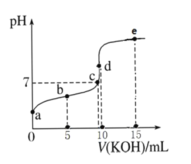
A.a 点溶液的 pH 约为 5
B.水的电离程度:c 点>d 点
C.b 点溶液中粒子浓度大小: c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
D.e 点溶液中:c(K+)=2c(A-)+2c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的K2S、KOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS、S2)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法不正确的是
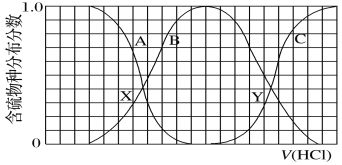
A.A曲线表示S2-随盐酸加入量增加时的分布分数改变情况
B.X、Y为曲线两交叉点。若已知Y点处的pH,则可计算Ka1(H2S)
C.X、Y点对应溶液中水的电离程度大小关系为:X<Y
D.Y点对应溶液中c(K+)与含硫各微粒浓度的大小关系为:c(K+)=3[c(H2S)+c(HS)+c(S2)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com