
【题目】下列对分子性质的解释中,不正确的是( )
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
C.![]() 的稳定性很强,是因为其分子间能形成氢键
的稳定性很强,是因为其分子间能形成氢键
D.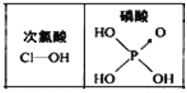 由图可知酸性:
由图可知酸性:![]() ,是因为
,是因为![]() 分子中有1个非羟基氧原子
分子中有1个非羟基氧原子
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是原子序数依次增大的短周期主族元素,X、Y 的最外层电子数均是其内层电子数的 ![]() ,下列叙述正确的是
,下列叙述正确的是
A.X 的单质着火时可用 CO2 扑灭
B.简单氢化物的稳定性:Y>Z>W
C.W 的氧化物对应的水化物均为强酸
D.YW3 和 Z2W2 中各原子最外层均满足 8 电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )

A. 在NaCl晶体中,距Na+最近的Cl-有6个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国矿石种类很多,如黄铜矿、煤、锰矿、锑锌矿等,请回答下列问题:
(l)黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),基态Cu2+的外围电子排布图为 ______,Fe2+含有 ___个未成对电子。
(2)Mn的第三电离能比Fe的第三电离能大的原因为 ___。
(3)煤化工可得氨气、苯、甲苯等产品,氨的空间构型为 ___,甲苯分子上甲基的碳原子的杂化方式为____;氨硼烷化合物(NH3BH3)是一种新型化学氢化物储氢材料,氨硼烷的结构式为____(配位键用“→”表示),与氨硼烷互为等电子体的有机小分子为_____写名称)。
(4)碲化锌的晶胞结构如图1所示。
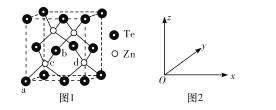
①碲化锌的化学式为____。
②图2可表示晶胞内部各原子的相对位置,已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),则d的原子坐标参数为____
),则d的原子坐标参数为____
③若两个距离最近的Te原子间距离为apm,阿伏加德罗常数值为NA,则晶体密度为____g/cm3(用含有NA、a的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 的3d轨道上有5个电子,试回答:
的3d轨道上有5个电子,试回答:
(1)M元素原子的核外电子排布式为________
(2)M元素原子的最外层电子数为______,价层电子数为______
(3)M元素在元素周期表中的位置为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)
NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)![]() 2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
(2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O)
化学键 | N≡O | Cl-Cl | Cl-N | N==O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
(3)300℃时,2NO(g)+Cl2 (g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/(mol·L-1) | v/(mol·L-1·s-l) |
① | 0. 30 | 3. 60×10-9 |
② | 0. 60 | 1. 44×10-8 |
③ | 0. 90 | 3. 24×10-8 |
n = ___;k = ____。
(4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g)![]() 2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
a.容器中的压强不变 b.2v正(NO) = v逆(Cl2)c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变
(5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g)![]() 2ClNO(g)△H。
2ClNO(g)△H。
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H __(填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图甲曲线b所示,则改变的条件是______。

②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”),m值为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N、P同属于元素周期表的第ⅤA族元素,N在第二周期,P在第三周期。![]() 分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H键间的夹角是
分子呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H键间的夹角是![]() 。
。
(1)![]() 分子的空间结构为
分子的空间结构为![]() ,它是一种_____(填“极性”或“非极性”)分子。
,它是一种_____(填“极性”或“非极性”)分子。
(2)![]() 分子与
分子与![]() 分子的构型关系_____(填“相同”“相似”或“不相似”),P—H键_____(填“有”或“无”)极性,
分子的构型关系_____(填“相同”“相似”或“不相似”),P—H键_____(填“有”或“无”)极性,![]() 分子_______(填“有”或“无”)极性。
分子_______(填“有”或“无”)极性。
(3)![]() 是一种淡黄色油状液体,下列对
是一种淡黄色油状液体,下列对![]() 的有关描述不正确的是___(填字母)。
的有关描述不正确的是___(填字母)。
a.该分子呈平面三角形
b.该分子中的化学键为极性键
c.该分子为极性分子
d.因N—Cl键的键能大,故![]() 稳定
稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在NH4+、Cl-、H+、OH-四种离子。下列各离子浓度关系一定不正确的是( )
A.c(NH4+)+c(H+)=c(Cl-)+c(OH-)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.c(NH4+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年化学诺贝尔奖授予拓展锂离子电池应用的三位科学家。如图是某锂—空气充电电池的工作原理示意图,下列叙述正确的是

A.电解质溶液可选用可溶性锂盐的水溶液
B.电池放电时间越长,Li2O2含量越少
C.电池工作时,正极可发生Li++O2-e- = LiO2
D.充电时,b端应接负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com