
【题目】下列实验方案不能达到实验目的的是
编号 | 实验目的 | 实验方案 |
A | 探究催化剂对 | 两支试管中均盛有 |
B | 探究 | 向盛有 |
C | 比较 | 两支试管中分别放入已除去氧化膜、大小相同的镁条和铝条,再各加入 |
D | 制取并纯化氢气 | 向稀盐酸中加入纯锌粒,将生成的气体依次通过浓硫酸、 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂-空气电池如图所示。当电池工作时,![]() 与
与![]() 在多孔碳材料电极处生成
在多孔碳材料电极处生成![]() (
(![]() 或1)。下列说法正确的是
或1)。下列说法正确的是
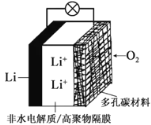
A.锂电极发生氧化反应
B.多孔碳材料电极为负极
C.电池工作时外电路电子由多孔碳材料电极流向锂电极
D.正极的电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图像正确的是( )
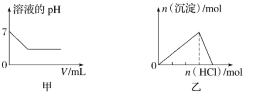
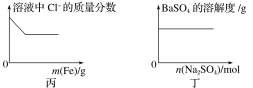
A.图甲为25℃时,向亚硫酸溶液中通入氯气
B.图乙为向NaAlO2溶液中通入HCl气体
C.图丙为向少量氯化铁溶液中加入铁粉
D.图丁为向BaSO4饱和溶液中加入硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲苯合成苯甲醛:
 ,
,
下列说法正确的是
A. 甲苯分子中所有原子都在同一平面内 B. 反应①②③的反应类型相同
C. 一氯甲苯的同分异构体有3种 D. 苯甲醇可与金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
①已知:放电时,负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2,则正极反应式为__。
②放电时,_____(填“正”或“负”)极附近溶液的碱性增强。
(2)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
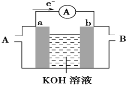
①使用时,空气从_____口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇(CH3OH),a极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍。下列判断正确的是
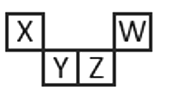
A.最高正化合价:X<Y<Z<W
B.原子半径:W<X<Y<Z
C.气态氢化物的热稳定性:Z<W
D.最高价氧化物对应水化物的酸性:Z<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究物质结构与性质之间的关系和元素性质的递变规律,设计了如下系列实验。回答下列问题:
I.NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低, 解释原因正确的是 (__________)
A.是因为NaNH2比NaOH 的相对分子质量小,前者分子间作用力小。
B.NaOH存在分子间氢键
C.NaNH2、NaOH均是离子化合物,其熔沸点高低与离子键的强弱有关,阴、阳离子电荷数越高,离子半径越小,离子键强度越大(或离子晶体的晶格能越大),则熔点越高。由于原子半径N>O,且NH2- 比OH- 原子个数多,则NH2- 比OH- 离子半径大,所以NaNH2比NaOH离子晶体的晶格能小,其熔点低。
D.N和O均处于第二周期,N在左方,同周期元素从左到右,元素的非金属性增强,其氢化物水溶液的酸性H2O>NH3,则碱性NaNH2>NaOH
II.根据下图所示装置回答以下问题。

(1)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证Cl的非金属性大于S:锥形瓶中发生反应的离子方程式为_________________________。试管中的实验现象为___________________________。
(2)若要用此装置证明非金属性: N>C>Si,从以下所给物质中选出实验所要用到物质:
①稀HNO3溶液 ②稀硫酸溶液 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
试剂A与C分别对应为_________________(填数字序号)。
有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为发生干扰的化学方程式为:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com