
【题目】下列材料中不含SiO2的是
A. 光纤 B. 玻璃 C. 石英 D. 芯片
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,10 min时达到平衡:PCl3(g) + Cl2(g)![]() PCl5(g)有关数据如下,下列判断不正确的是
PCl5(g)有关数据如下,下列判断不正确的是
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
A. 10 min内,v(Cl2) = 0.04 mol/(L·min)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 若升高温度(T1<T2)时,该反应平衡常数减小,则平衡时PCl3的![]()
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH1
2 H2(g)+ O2(g) 2H2O(g) ΔH2
C(s)+ O2(g) CO2(g) ΔH3
则反应4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
A. 12ΔH3+5ΔH2-2ΔH1 B. 2ΔH1-5ΔH2-12ΔH3
C. 12ΔH3-5ΔH2-2ΔH1 D. ΔH1-5ΔH2-12ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g)![]() B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况,根据下述数据,完成下列填空:
实验 序号 | 温度/℃ | 时间/min | ||||||
0 | 10 | 20 | 30 | 40 | 50 | 60 | ||
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c 3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验l过程中,10 min~20 min时间内用B表示该反应的平均化学反应速率为_________mol/(L·min)。
(2)在实验2过程中,A的初始浓度c2=______mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是___________________________。
(3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3_____v1,且c3________1.0 mol/L (填“<”、“>”或“=”)。
(4)比较实验4和实验l,可推测该反应是___________反应(填“吸热”或“放热”)。理由是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.往K2CrO4溶液中加酸,使溶液橙色加深
D.Fe(SCN)3溶液中加入几滴6mol/L NaOH溶液后溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和C原子最外层只有一个电子,C燃烧时的焰色反应是黄色,C的单质在高温下与B的单质充分反应可以产生淡黄色固态化合物,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,试根据以上叙述回答:
(1)写出B、D的元素名称:BD .
(2)写出化学方程式:C+B= ,
(3)C元素离子的离子结构示意图
(4)写出A2B、C2B2的电子式、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)下列反应中,属于放热反应的是 , 属于吸热反应的是(填序号). ①煅烧石灰石②木炭燃烧③炸药爆炸④酸碱中和⑤生石灰与水作用制熟石灰⑥消石灰与氯化铵制备氨气
(2)用锌片、铜片连接后浸入硝酸银溶液中,构成了原电池,此电池的负极是 , 电路中电子的流向是 , (填“从锌到铜”或者“从铜到锌”),正极的电极反应式是 . 工作一段时间,锌片的质量减少了3.25g,则铜表面析出了银g,导线中通过mol电子.
(3)某化学反应,设反应物的总能量为E1 , 生成物的总能量为E2 , 若E1>E2 , 则该反应为热反应,中和反应都是热反应,其实质是 . (用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变发生反应:A(g)+3B(g) ![]() 2C(g)+D(s) ΔH<0
2C(g)+D(s) ΔH<0
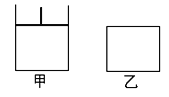
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是 。
A.混合气体的总质量不随时间改变
B.2 v正(C) = 3v逆(B)
C.A、B转化率相等
D.物质D的质量不随时间改变
(2)2min后甲容器中反应达到平衡,测得C的浓度为2mol/L,此时甲容器的体积为_______mL。
(3)当甲乙两容器中反应都达平衡时,甲和乙中B的转化率α甲(B) _________α乙(B)。(填“>”“<”或“=”)
(4)其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C)=________mol,加入D的物质的量n(D)应该满足的条件为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com