
����Ŀ����ͼ���мס�����������������ɱ�ѹǿ���䣬�ұ���������䡣���������зֱ����1molA��3molB����ʱ�����������Ϊ500mL���¶�ΪT���������¶Ȳ��䷢����Ӧ��A(g)+3B(g) ![]() 2C(g)+D(s) ��H<0
2C(g)+D(s) ��H<0
��1������ѡ���У��ܱ������������з�Ӧһ���ﵽƽ��״̬���� ��
A��������������������ʱ��ı�
B��2 v��(C) = 3v��(B)
C��A��Bת�������
D������D����������ʱ��ı�
��2��2min��������з�Ӧ�ﵽƽ�⣬���C��Ũ��Ϊ2mol/L����ʱ�����������Ϊ_______mL��
��3���������������з�Ӧ����ƽ��ʱ��������B��ת���ʦ���(B) _________����(B)�����>����<����=����
��4�������������䣬����������淴Ӧ����ʼ��Ӧ����ƽ�⣬Ҫ��ƽ��ʱC�����ʵ����루2����ƽ��ʱC�����ʵ�����ȣ�����Ҫ����C�����ʵ���n(C)=________mol������D�����ʵ���n(D)Ӧ�����������Ϊ______________��
���𰸡���1��A D��2������2��400 ��2������3��>��2������4��2��2������n(D)>0.6mol��2����
��������
�����������1����һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬��A����Ӧ�й������ɣ������淴Ӧ���������������С��������������������ʱ��ı䣬˵������ƽ�⣬A��ȷ��B����ͬ���ʱ�ʾ���淴Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ�˵����Ӧ����ƽ�⣮2v����C��=3v����B������v����C����v����B��=3��2�������ڻ�ѧ������֮��2��3��B����C����ʼ���������зֱ����1molA��3molB����A��B��1��3��Ӧ�������Ƿ�ƽ��A��B��ת������ʼ���ն���ȣ�C����D���淴Ӧ���������������С������D������������D����������ʱ��ı䣬˵������ƽ�⣬D��ȷ����ѡAD��
��2��������ɱ䣬ѹǿ�¶Ȳ��䣬��Ӧǰ�����������Ũ����ȣ���λ����ں��еĻ����������ʵ�����ȣ�����ʼ����1molA��3molB�����Ϊ500ml����ʼ����������Ũ��Ϊ��1mol+3mol����0.5L=8mol/L��ƽ���C��Ũ��Ϊ2mol/L����ƽ��ʱA��B���ܵ�Ũ��Ϊ8mol/L-2mol/L=6mol/L�����ڿ�ʼ����1molA��3molB����A��B��1��3��Ӧ������ƽ��ʱA��B��Ũ�ȱ�Ϊ1��3������ƽ��ʱc��A��=1/4��6mol/L=1.5mol/L��c��B��=6mol/L-1.5mol/L=4.5mol/L����ƽ�������ΪVL����ƽ��ʱn��A��=1.5Vmol��n��B��=4.5Vmol��n��C��=2Vmol������
A��g��+3B��g��![]() 2C��g��+D��s��
2C��g��+D��s��
��ʼ����mol����1 3 0 0
ת������mol����V 3V 2V V
ƽ������mol����1-V 3-3V 2V V
����1-V=1.5V������V=0.4����ƽ�������Ϊ400ml��
��3����Ӧǰ�����������С���ױ���ѹǿ��ѹǿ����ƽ���������С�ķ����ƶ�����������Ӧ�ƶ������Լ���B��ת���ʱ����еĴ�������B����������B����
��4��ƽ��ʱC�����ʵ����루2����ƽ��ʱC�����ʵ�����ȣ���Ϊ��ȫ��Чƽ�⣬��ʼ1molA��3molB����ѧ������ת�����ұ߿ɵ�n��C��=2mol������n��C��=2mol���ɣ�2����֪��ƽ��ʱC�����ʵ���Ϊ2Vmol=2��0.4mol=0.8mol������ת����C�����ʵ���Ϊ2mol-0.8mol=1.2mol���ɷ���ʽ��֪����ҪD�����ʵ���Ϊ1/2��1.2mol=0.6mol����n ��D����0.6mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʿ����Ұ�����ʳ��ʱͨ�����á�����ʳ���������������Ҫ��ѧ�ɷ�Ϊþ�ۡ����ۡ��Ȼ��Ʒ�ĩ��ʹ��ʱ����ˮ�����е�þ��Ӧ�ų��������������������¶Ա���Ʒ������̽��ʵ�飮 ʵ��1������е���ˮ��������ͬ���������зֱ�������и������ʣ������ͼ1��
��1.0molþ����0.10mol���ۡ�0.10mol�Ȼ��Ʒ�ĩ��
�ڽ�1.0molþ������100�ݡ�0.10mol���ۡ�0.10mol �Ȼ��Ʒ�ĩ��
��1.0molþ�ۡ�0.10mol ���ۡ�0.10mol�Ȼ��Ʒ�ĩ��
ʵ��2�������100mLˮ�Ķ����ͬ�ĸ��������зֱ������0.10molþ�ۡ�0.50mol���ۼ���ͬ�����Ȼ��Ʒ�ĩ��ɵĻ������Ͻ��裬��15minʱ��¼�¶����ߵķ��ȣ������ͼ2��
��ش��������⣺
��1��ʵ��1֤ʵ�˸÷�Ӧ�ķ�Ӧ�������йأ�
��2��ʵ��2�е�NaCl����������0.125molʱ��ʵ�������������ԭ��������ѡ����ĸ����
A.��������NaCl�������ӷ�Ӧ����
B.����NaCl�����ή�ͷ�Ӧ����
C.�Ѵﵽ�е㲻�����¶ȱ仯
D.��Ҫ������������������¶�
��3�������ʵ��2�м���0.060mol��NaCl�����15minʱ�������¶���ӽ���������ĸ����
A.34��
B.42��
C.50��
D.62��
��4���������ۺ�NaCl��ʹ��Ӧ���ʼӿ��ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ���е����ʵ����� Na+��Fe3+��Ba2+��I����SO42-��SO32-��Cl-�еļ������ӡ�ȡ�������� KSCN��Һ����Һ��Ѫ��ɫ������Һ�����������
A.һ��û�� Ba2+B.���ܺ��� Na+
C.һ��û�� SO32��D.һ���� Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʹ����ͼ��ʾװ�ý��л�ѧСʵ�飬����д���пհף� 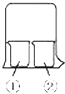
��1�������з�һƬʪ��ĺ�ɫʯ����ֽ����װ��Ũ��ˮ���ɹ۲쵽��ʵ������Ϊ
��2������װ��AlCl3��Һ����װ��Ũ��ˮ���ɹ۲쵽��ʵ������Ϊ
��3������װ��Ũ���ᣬ��װ��Ũ��ˮ���ɹ۲쵽��ʵ������Ϊ
��4������װ��Ũ���ᣬ��װ��Na2SO3��Һ��ʵ��ʱ����ɫ�����������������Ϊ����ɫ���û�ѧ����ʽ��ʾ��ɫ�����Ϊ����ɫ��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ��Ϊԭ�����ɾ�ϩ���IJ������£�
![]()
�Իش�
��1������10����ԭ�ӵ������ķ���ʽΪ_____________��
��2��C4��C10���������ﺬ��______________(������������������������������)7�ֲ�ͬ�����ʡ�
��3��д���ɱ�ϩ���ɾ۱�ϩ�Ļ�ѧ����ʽ________________________________________������__________���ͷ�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¡���ѹ�£����и��������ܹ�����ǣ� ��
A. NO��O2 B. SO2��O2 C. H2S��SO2 D. NH3��HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�����ܱ������г���2 mol X��1mol Y������Ӧ��2X(g)+Y(g) ![]() 3Z(g) ����Ӧ���̳��������¶ȣ���û����ϵ��X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ����( )
3Z(g) ����Ӧ���̳��������¶ȣ���û����ϵ��X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ����( )
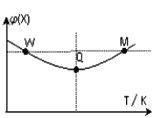
A. Q��ʱ��Y��ת�������
B. W��X������Ӧ���ʵ���M��X������Ӧ����
C. �����¶ȣ�ƽ�ⳣ������
D. �¶�һ����ƽ��ʱ����Z���ﵽ��ƽ��ʱZ�����������ԭƽ��ʱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ���������е�����ѡ�õ��Լ��ͷ������������
���� | ���� | �Լ� | ���� | |
A | ������̼ | �������� | ����̼������Һ | ϴ�� |
B | �Ȼ�������Һ | �Ȼ��� | �������� | ���� |
C | �������� | ������ | ����������Һ | ���� |
D | ͭ | ����ͭ | ϡ���� | ��ȡ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com