
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | (C)反应不十分强烈,产生的气体可以在空气中燃烧 |
| ④镁带与2 mol·L-1的盐酸反应 | (D)剧烈反应,产生可燃性气体 |
| ⑤铝条与2 mol·L-1的盐酸反应 | (E)生成白色胶状沉淀,既而沉淀消失 |
| ⑥向AlCl3溶液滴加NaOH溶液至过量 | (F)生成淡黄色沉淀 |


 互动英语系列答案
互动英语系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
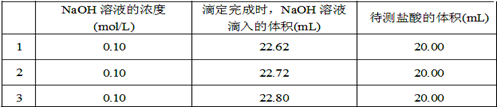
| A.滴定终点读数时俯视读数 | B.碱式滴定管尖嘴部分有气泡,滴定后消失 |
| C.锥形瓶水洗后未干燥 | D.称量NaOH固体中混有Na2CO3固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.蒸馏 | B.重结晶 | C.过滤 | D.萃取 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
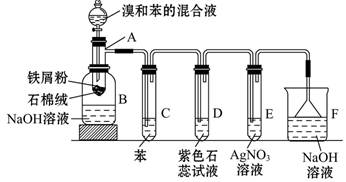
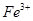 外还可能含有
外还可能含有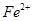 。若要确认其中的
。若要确认其中的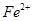 ,应选用 选填序号)。
,应选用 选填序号)。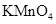 溶液
溶液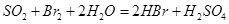 ,然后加入足量
,然后加入足量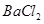 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中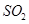 的体积分数为 。
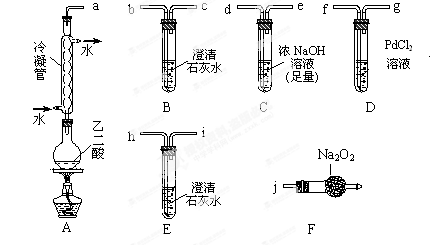
的体积分数为 。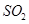 体积分数的结果,丙同学认为气体Y中还可能含量有
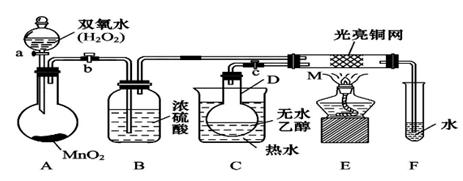
体积分数的结果,丙同学认为气体Y中还可能含量有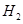 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。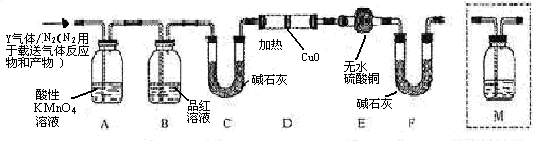
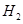 ,预计实验现象应是 。
,预计实验现象应是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.氯化钠溶液 | B.苯 | C.碳酸氢钠溶液 | D.四氯化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com