
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3, 其原理如图所示,其中A、B为多孔材料。下列说法正确的是
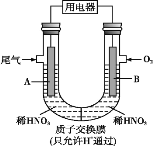
A. 电解质溶液中电流的方向由B到A,电子的流向与之相反
B. 电极A表面反应之一为NO-3e-+2H2O=NO3-+4H+
C. 电极B附近的c(NO3-)增大
D. 该电池工作时,每转移4 mol电子,消耗22.4 LO2
【答案】B
【解析】
由示意图可知,该装置为原电池,电池工作时通入汽车尾气(NO、NO2)的A极为负极,尾气在负极失电子发生氧化反应生成HNO3,电极反应式为NO2-e-+H2O=NO3-+2H+或NO-3e-+2H2O=NO3-+4H+,通入氧气的B极为正极,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O。
A项、电解质溶液中是通过阴阳离子的定性移动形成电流,故A错误;
B项、该原电池中,通入氮氧化物的A电极是负极,负极上氮氧化物失电子发生氧化反应生成硝酸,电极A表面反应之一为NO-3e-+2H2O=NO3-+4H+,故B正确;
C项、通入氧气的B极为正极,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,放电时有水生成,电极B附近硝酸根离子浓度减小,故C错误;
D项、没有明确是否为标准状况,无法计算氧气体积,故D错误。
故选B。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(14分)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。

已知:P204[二(2乙基己基)磷酸酯]常用于萃取锰,P507(2乙基己基膦酸2乙基己酯)和Cyanex272[二(2,4,4)三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式__________________________________。
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:

加入NaOH溶液调pH=5可除去图中的________(填金属离子符号)杂质;写出除去金属离子的离子方程式________________________(一种即可)。
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)![]() MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)![]() MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________。
MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________。
(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。

■—Co(Cyanex272);●—Ni(Cyanex272);▲—Co(P507);▼—Ni(P507)
由图可知,钴、镍的萃取率随萃取剂浓度增大而_________(填“增大”或“减小”);两种萃取剂中___________(填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为__________mol·L1;若选Cyanex272萃取剂,则最适宜的萃取剂浓度大约为___________mol·L1。
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×1016,则沉镍母液中Ni2+的浓度为2.1×1011 mol·L1时,pH=______(lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A. CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -1452 kJ/mol
C. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -725.8 kJ/mol
D. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=" +1452" kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中加入CaSO4和CO,在一定温度下,发生反应:CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1
CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1

CO的反应速率随时间变化如图所示。下列说法正确的是( )
A.该反应是吸热反应,升高温度,正反应速率增大,逆反应速率减小
B.CaO是固态,不能用CaO表示反应的快慢
C.图示中t1时改变的条件可能是减小c(CO),同时增大c(SO2)
D.图示中t1时改变的条件可能是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温“可呼吸” Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是

A.“吸入”CO2时,钠箔为正极
B.“呼出”CO2时,Na+向多壁碳纳米管电极移动
C.“吸入” CO2时的正极反应式为:4Na++3CO2+4e-=2Na2CO3+C
D.标准状况下,每“呼出”22.4 L CO2,转移电子的物质的量为0.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源,以太阳能为热能,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

(1)反应I的化学方程式是________。
(2)反应I得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层,含低浓度I2的H2SO4层和含高浓度I2的HI层。
①根据上述事实,下列说法正确的是________(选填序号)。
a 两层溶液的密度存在差异
b 加I2前,H2SO4溶液和HI溶液不互溶
c I2在HI溶液中比在H2SO4溶液中易溶
② 辨别两层溶液的方法是____________。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因______。
(3)反应II : 2H2SO4(l)=2SO2(g) +O2(g) +2H2O(g) △H=+550 kJ mol-1
它由两步反应组成:
i.H2SO4(l)=SO3(g) +H2O(g) △H =+177 kJ mol-1
ii.SO3(g)分解。
L(L1, L2)和X可分别代表压强或温度,下图表示L一定时,ⅱ中SO3(g)的平衡转化率随X的变化关系。

①写出反应iiSO3(g)分解的热化学方程式:________。
②X代表的物理量是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)元素Y在周期表中的位置是___,丙分子的电子式为____。
(2)若甲与Y单质在常温下混合就有明显红棕色气体的现象,则甲的化学式为___。丙在一定条件下转化为甲和乙的反应方程式为___。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为___(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
写出戊与烧碱的浓溶液加热时反应的离子方程式___。
(4)在标准状况下,用装满丙气体的烧瓶做喷泉实验,喷泉结束后水充满烧瓶,假设烧瓶中溶质不能扩散出来,则所得溶液的物质的量浓度为____。(保留两位有效数字)
(5)X与Y两种元素之间可形成一种18e-微粒的分子,此分子是医疗上常用的消毒剂,请写出此分子的结构式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如下图所示。

(1)途径Ⅰ碱浸时发生反应的化学方程式为_________________________。
(2)途径Ⅱ氧化时还有Na2SO4生成,则反应的离子方程式为___________________________。
(3)已知途径Ⅰ的钼酸钠溶液中c(MoO42-)=0.40mol·L-1,c(CO32-)=0.10mol·L-1。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是___[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图。


①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是_____________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠(M=206g·mol-1)的物质的量浓度为_____(计算结果保留3位有效数字)。
(5)二硫化钼用作电池的正极材料时接受Li+的嵌入,锂和二硫化钼形成的二次电池的总反应为xLi+nMoS2 Lix(MoS2)n,则电池放电时正极的电极反应是_________。
Lix(MoS2)n,则电池放电时正极的电极反应是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com