
【题目】常温下,0.1 mol/LH2C2O4水溶液中存在H2C2O4、HC2O4-和C2O42-三种形态含碳粒子,用NaOH或HCl调节该溶液的pH,三种含碳粒子的分布系数δ随溶液pH变化的关系如下图[已知:a=1.35,b=4.17,Ksp(CaC2O4)=2.3×10-9,忽略溶液体积变化]。下列说法错误的是
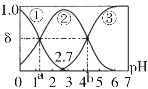
A.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
B.已知pKa=-lgKa,则pKa2 (H2C2O4)=4.17
C.0.1mol/LNaHC2O4溶液中:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
D.一定温度下往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
【答案】AD
【解析】
根据图示可知①表示H2C2O4,②表示HC2O4-,③C2O42-的含量。
A. pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4),A错误;
B. Ka2 (H2C2O4) =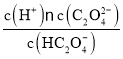 ,当溶液中c(C2O42-)=c(HC2O4-),Ka2 (H2C2O4)=c(H+)=10-4.17,所以根据pKa=-lgKa,可知pKa2 (H2C2O4)=4.17,B正确;
,当溶液中c(C2O42-)=c(HC2O4-),Ka2 (H2C2O4)=c(H+)=10-4.17,所以根据pKa=-lgKa,可知pKa2 (H2C2O4)=4.17,B正确;
C. 根据物料守恒可得:c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),根据电荷守恒可得:c(Na+)+c(H+)= c(OH-)+c(HC2O4-)+2c(C2O42-),将两式联立整理可得c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4),C正确;
D. 一定温度下CaC2O4饱和溶液中存在平衡:CaC2O4(s)![]() Ca2+(aq)+ C2O42-(aq),向其中加入少量CaCl2固体,平衡逆向移动,使c(C2O42-)减小,但最终c(Ca2+)增大,D错误;
Ca2+(aq)+ C2O42-(aq),向其中加入少量CaCl2固体,平衡逆向移动,使c(C2O42-)减小,但最终c(Ca2+)增大,D错误;
故合理选项是AD。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述错误的是

A. 图甲表示分别用NaOH溶液滴定等浓度等体积的盐酸和醋酸溶液反应变化曲线,指示剂都可用酚酞
B. 图乙表示分别用等浓度AgNO3溶液滴定等浓度等体积的NaCl、NaBr及NaI溶液反应变化曲线(X-表示Cl-、Br-、I-),则c为I–(溶度积常数:Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl))
C. 图丙表示一定温度下,水溶液中H+和OH-的浓度变化曲线,b→a可能是加CuCl2溶液导致的
D. 图丁表示其他条件不变时,可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0 , C的物质的量分数与温度的关系
2C(g) ΔH<0 , C的物质的量分数与温度的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+HI(g)
H2(g)+HI(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
A.9B.16C.20D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。
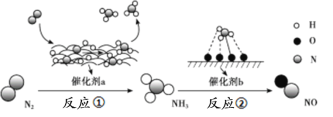

下列分析合理的是
A.如图中c曲线是加入催化剂a时的能量变化曲线
B.反应①的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L
D.催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知每个手性碳原子具有一对旋光异构体,也称对映异构体。据此化合物![]() 分子中有a种化学环境不同的氢原子,如果用氯取代分子中的氢原子,生成的一氯代物可能有b种,则a、b分别是
分子中有a种化学环境不同的氢原子,如果用氯取代分子中的氢原子,生成的一氯代物可能有b种,则a、b分别是
A.3、6B.4、8C.4、6D.4、12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种烈化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:
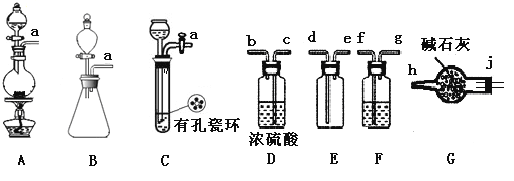
(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
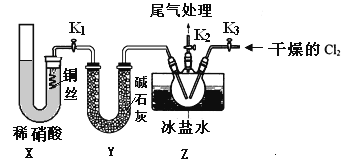
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7).工艺流程如图1及相关物质溶解度曲线如图2:
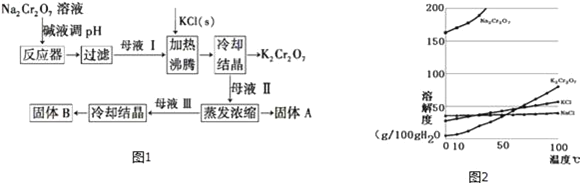
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为:____________.通过冷却结晶析出大量K2Cr2O7的原因是____________.
(2)向Na2Cr2O7母液中加碱液调pH的目的是____________.
(3)固体A主要为____________(填化学式),固体B主要为____________(填化学式).
(4)为检验得到的重铬酸钾晶体中含有少量的氯化钠杂质,实验方法是:____________;进一步提纯产品的方法是____________
(5)将SO2通入用硫酸酸化的重铬酸钾溶液中,可制得硫酸铬钾KCr(SO4)2,反应的化学方程式为____________;如果溶液的酸碱性控制不当,可能会有Cr(OH)SO4杂质生成.现从得到的硫酸铬钾产品中取出3.160g样品加入足量盐酸和BaCl2溶液后,得到白色沉淀5.126g.若产品中杂质只有Cr(OH)SO4,则该产品中KCr(SO4)2的质量分数为____________(用百分数表示,保留1位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol过氧化钠中阴离子所带的负电荷数为NA
B.14 g乙烯和丙烯的混合物中含有的碳原子的数目为NA
C.28 g C16O与28 g C18O中含有的质子数均为14 NA
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙酸中的氧都是18O,则乙酸和乙醇在一定条件下反应,经过足够长的时间后,体系中含有18O的物质是
A. 只有乙酸
B. 只有乙酸乙酯
C. 乙酸、乙酸乙酯、水
D. 乙酸乙酯、乙醇、水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com