
【题目】已知每个手性碳原子具有一对旋光异构体,也称对映异构体。据此化合物![]() 分子中有a种化学环境不同的氢原子,如果用氯取代分子中的氢原子,生成的一氯代物可能有b种,则a、b分别是
分子中有a种化学环境不同的氢原子,如果用氯取代分子中的氢原子,生成的一氯代物可能有b种,则a、b分别是
A.3、6B.4、8C.4、6D.4、12
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.往等c(H+)和等体积的盐酸和醋酸中,分别加足量相同的锌片,相同状况下,与醋酸反应产生的气体体积更大
C.已知H2CO3 的 Ka1= 4.30×10-7,Ka2= 5.61×10-11,HClO的 Ka = 3.0×10-8,则反应CO2+H2O+2NaClO=Na2CO3+2HClO能够成立
D.等c(H+)的盐酸和醋酸,加水稀释100倍后,c(H+)前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.室温时,Ka=1×10-5浓度为0.1mol/L的HA溶液,pH=3
B.将pH=2的HCl溶液和pH=4的H2SO4溶液等体积混合,所得溶液pH=3
C.0.1 mol/L氨水和0.1 mol/L NH4Cl溶液等体积混合后所得溶液pH>7,则c(NH4+) < c(NH3·H2O)
D.向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液反应的离子方程式为:HA-+ OH- = H2O + A2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g) ![]() pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n≠p+q,温度不变时压强增大到原来的2倍,达到新平衡时,总体积一定比原来的![]() 要小
要小
D.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式______________
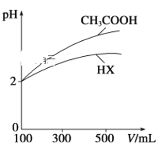
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中![]() =____。
=____。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/LH2C2O4水溶液中存在H2C2O4、HC2O4-和C2O42-三种形态含碳粒子,用NaOH或HCl调节该溶液的pH,三种含碳粒子的分布系数δ随溶液pH变化的关系如下图[已知:a=1.35,b=4.17,Ksp(CaC2O4)=2.3×10-9,忽略溶液体积变化]。下列说法错误的是
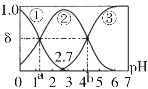
A.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
B.已知pKa=-lgKa,则pKa2 (H2C2O4)=4.17
C.0.1mol/LNaHC2O4溶液中:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
D.一定温度下往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl﹣、SO42﹣)中回收氧化铁流程如图:

已知:常温下Ksp[Mg(OH)2]=1.2×10﹣11; Ksp[Fe(OH)2]=2.2×10﹣16;Ksp[Fe(OH)3]=3.5×10﹣38;Ksp[Al(OH)3]=1.0×10﹣33。
(1)写出在该酸性废液中通入空气时发生的离子反应方程式_____。
(2)常温下,根据已知条件在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=_____。
(3)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用_____试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1molH—H键断裂的同时断裂2molH—O键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com