
【题目】对于平衡体系mA(g)+nB(g) ![]() pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n≠p+q,温度不变时压强增大到原来的2倍,达到新平衡时,总体积一定比原来的![]() 要小
要小
D.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
【答案】C
【解析】
根据题中平衡体系可知,本题考查化学平衡建立的过程,运用勒夏特列原理分析。
A. 将容器的体积缩小到原来的一半,不考虑平衡移动,此时A的浓度变为原来的2倍,现在A的浓度为原来的2.1倍,说明平衡向着生成A的方向移动了,体积缩小即增大压强,平衡向着气体体积减小的方向进行,所以m+n<p+q,故A正确;
B. 反应开始时,A、B的物质的量之比为m:n,恰好等于方程式的系数值比,这种情况下平衡时,A、B的转化率相等,故B正确;
C. 若该反应中,m+n=p+q,温度不变时,压强增大到原来的2倍,达到新平衡时,总体积变为原来的12,故C错误;
D. 若m+n=p+q,则往含有amol气体时建立的平衡和向平衡体系中加入amol的B时建立的平衡等同,所以往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol,故D正确;
答案选C。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】第20届中国国际工业博览会上,华东师范大学带来的一种“锌十碘”新型安全动力电池亮相工博会高校展区。该新型安全动力电池无污染、高安全、长寿命且具有合适的充电时间,可以应用于日常生活、交通出行等各个领域。已知该电池的工作原理如图所示。下列有关说法正确的是( )
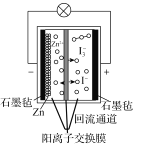
A.正极反应式为I3--2e-=3I-
B.6.5gZn溶解时,电解质溶液中有0.2mol电子移动
C.转移1mol电子时,有1molZn2+从左池移向右池
D.“回流通道”可以减缓电池两室的压差,避免电池受损
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,FeS的Ksp=6.25×10-18(设饱和溶液的密度为1g/mL)。若已知H2S饱和溶液在常温下,c(H+)与c(S2-)之间存在以下关系:c2(H+)·c(S2-)=1.0×10-22,在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe 2+)达到1mol/L,应调节溶液的pH为___________
(已知:lg2 = 0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+HI(g)
H2(g)+HI(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
A.9B.16C.20D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用![]() 溶液、尿素
溶液、尿素![]() 为原料制取水合肼
为原料制取水合肼![]() 的流程如下:
的流程如下:
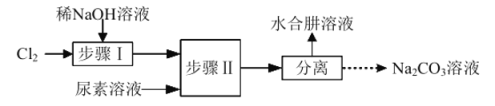
已知:①![]()
②![]() 沸点约
沸点约![]() ,具有强还原性,能与
,具有强还原性,能与![]() 剧烈反应生成
剧烈反应生成![]() 。
。
下列说法错误的是( )
A.步骤Ⅰ、Ⅱ反应过程中需控制好温度
B.所得副产物![]() 可用于工业上吸收
可用于工业上吸收![]() 尾气
尾气
C.步骤Ⅱ具体操作为将尿素溶液逐滴加入![]() 溶液中
溶液中
D.水合肼与![]() 反应的离子方程式为:
反应的离子方程式为:![]() ↑
↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。
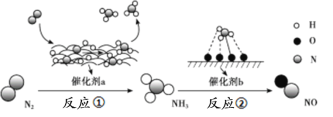

下列分析合理的是
A.如图中c曲线是加入催化剂a时的能量变化曲线
B.反应①的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L
D.催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知每个手性碳原子具有一对旋光异构体,也称对映异构体。据此化合物![]() 分子中有a种化学环境不同的氢原子,如果用氯取代分子中的氢原子,生成的一氯代物可能有b种,则a、b分别是
分子中有a种化学环境不同的氢原子,如果用氯取代分子中的氢原子,生成的一氯代物可能有b种,则a、b分别是
A.3、6B.4、8C.4、6D.4、12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7).工艺流程如图1及相关物质溶解度曲线如图2:
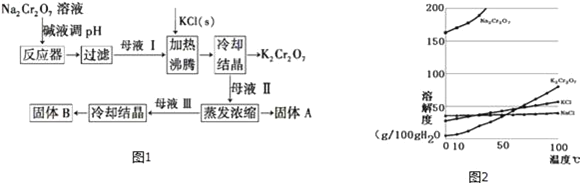
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为:____________.通过冷却结晶析出大量K2Cr2O7的原因是____________.
(2)向Na2Cr2O7母液中加碱液调pH的目的是____________.
(3)固体A主要为____________(填化学式),固体B主要为____________(填化学式).
(4)为检验得到的重铬酸钾晶体中含有少量的氯化钠杂质,实验方法是:____________;进一步提纯产品的方法是____________
(5)将SO2通入用硫酸酸化的重铬酸钾溶液中,可制得硫酸铬钾KCr(SO4)2,反应的化学方程式为____________;如果溶液的酸碱性控制不当,可能会有Cr(OH)SO4杂质生成.现从得到的硫酸铬钾产品中取出3.160g样品加入足量盐酸和BaCl2溶液后,得到白色沉淀5.126g.若产品中杂质只有Cr(OH)SO4,则该产品中KCr(SO4)2的质量分数为____________(用百分数表示,保留1位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为
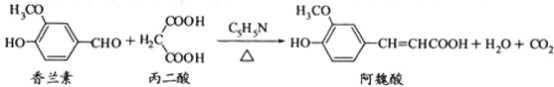
下列说法正确的是
A.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应
C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D.1mol香兰素最多可以与4molH2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com