
【题目】常温下,FeS的Ksp=6.25×10-18(设饱和溶液的密度为1g/mL)。若已知H2S饱和溶液在常温下,c(H+)与c(S2-)之间存在以下关系:c2(H+)·c(S2-)=1.0×10-22,在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe 2+)达到1mol/L,应调节溶液的pH为___________
(已知:lg2 = 0.3)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。如图是该反应生成1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________。

(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应Ⅰ:2NO(g)![]() N2O2(g)(快) ΔH1<0,v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
N2O2(g)(快) ΔH1<0,v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
反应Ⅱ:N2O2(g)+O2(g)![]() 2NO2(g)(慢)ΔH2<0,v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2(NO2)。
2NO2(g)(慢)ΔH2<0,v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2(NO2)。
①一定条件下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。反应Ⅰ的活化能EⅠ___________(填“>”“<”或“=”)反应Ⅱ的活化能EⅡ。
2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。反应Ⅰ的活化能EⅠ___________(填“>”“<”或“=”)反应Ⅱ的活化能EⅡ。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数__________(填“大于”“小于”或“等于”)k2逆增大的倍数。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。
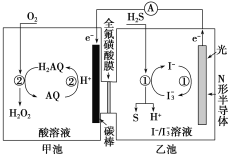
①装置中H+向_______池迁移。
②乙池溶液中发生反应的离子方程式:_______。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25 ℃,某废液中c(Mn2+)=0.02 mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1 mol·L-1,此时pH约为_______(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:Ka1=1.5×10-7,Ka2=6.0×10-15,lg 6=0.8)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.往等c(H+)和等体积的盐酸和醋酸中,分别加足量相同的锌片,相同状况下,与醋酸反应产生的气体体积更大
C.已知H2CO3 的 Ka1= 4.30×10-7,Ka2= 5.61×10-11,HClO的 Ka = 3.0×10-8,则反应CO2+H2O+2NaClO=Na2CO3+2HClO能够成立
D.等c(H+)的盐酸和醋酸,加水稀释100倍后,c(H+)前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。
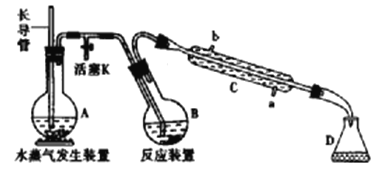
(1)A的名称是___________,长导管用于平衡压强,实验过程中其下端___________(填“能”或“不能”)在液面以上。
(2)仪器C是直形冷凝管,实验过程中,冷却水应从___________口出。(填“a”或“b")
(3)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏:若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。
(4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是___________。
(5)B中加入一定体积高氯酸和1.00g氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。
①下列物质不可代替高氯酸的是___________(填标号)
a.醋酸 b.硝酸 c.磷酸 d.硫酸
②D中主要反应的离子方程式为_________________________________。
(6)向馏出液中加入25.00mL0.100mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用0.100 mol·L -1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1︰1络合),消耗EDTA标准溶液20.00mL,则氟化稀土样品中氟的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.测定盐酸和NaOH溶液反应的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH溶液的起始温度和反应体系的最高温度
B.HCl和NaOH反应的中和热ΔH=57.3 kJ·mol1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热 ΔH=2×57.3 kJ·mol1
C.燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量
D.S燃烧热的热化学方程式为S(s)+![]() O2(g)=SO3(g) ΔH=315 kJ·mol-1
O2(g)=SO3(g) ΔH=315 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。
已知:① CO(g)+![]() O2(g) = CO2 (g) △H=-283kJ·mol-1
O2(g) = CO2 (g) △H=-283kJ·mol-1
② H2(g)+![]() O2(g) = H2O (g) △H=-241.8kJ·mol-1
O2(g) = H2O (g) △H=-241.8kJ·mol-1
③ H2O (l)=H2O (g) △H=+44.0kJ·mol-1
(1)H2的燃烧热△H=________。
(2)写出CO(g)和H2O (g)作用生成CO2 (g)和H2(g)的热化学方程式:________。
(3)相关物质的化学键键能数据如下:
化学键 | O=O(O2) | H—H | H—O |
E/(kJ·mol-1) | x | 436 | 463 |
计算x=________kJ·mol-1。
(4)某反应2X(g)+Y(g)2Z(g) △H= -Q kJ·mol-1,反应过程中能量变化如图所示,其中虚线表示加入催化剂M时的情况。
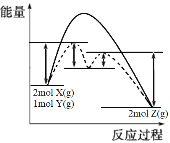
①加入催化剂M后,△H________ (填“改变”或“不变”)。
②在使用催化剂的两部反应中,________ (填“第一步”或“第二步”)决定反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.室温时,Ka=1×10-5浓度为0.1mol/L的HA溶液,pH=3
B.将pH=2的HCl溶液和pH=4的H2SO4溶液等体积混合,所得溶液pH=3
C.0.1 mol/L氨水和0.1 mol/L NH4Cl溶液等体积混合后所得溶液pH>7,则c(NH4+) < c(NH3·H2O)
D.向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液反应的离子方程式为:HA-+ OH- = H2O + A2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g) ![]() pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n≠p+q,温度不变时压强增大到原来的2倍,达到新平衡时,总体积一定比原来的![]() 要小
要小
D.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl﹣、SO42﹣)中回收氧化铁流程如图:

已知:常温下Ksp[Mg(OH)2]=1.2×10﹣11; Ksp[Fe(OH)2]=2.2×10﹣16;Ksp[Fe(OH)3]=3.5×10﹣38;Ksp[Al(OH)3]=1.0×10﹣33。
(1)写出在该酸性废液中通入空气时发生的离子反应方程式_____。
(2)常温下,根据已知条件在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=_____。
(3)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用_____试剂可将其除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com