
【题目】500 mL含有MgCl2、NaCl、Na2SO4三种物质的混合溶液,已知其中含有Cl为1.8 mol,Na+为2 mol,Mg2+为0.5 mol,则![]() 的物质的量浓度为
的物质的量浓度为
A.0.6 mol /L B.0.7 mol /L C.1.2 mol /L D.1.0 mol /L
科目:高中化学 来源: 题型:
【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时:c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通常情况下,A是单质,A、B、C、D均含有同一种元素,它们的相互转化关系如图所示。

(1)若A为黄色粉末,则A为_____,B为_______,C为_____, D为_____。D→B的反应方程式为________________
(2)若A为无色气体,则A为_____,B为_____,C为_____,D为______。
C→D的反应方程式为_________________________,
D→B的反应方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L 0.1 mol·L1的K2SO4溶液中
A.K+的物质的量为0.1 mol
B.![]() 的物质的量为0.2 mol
的物质的量为0.2 mol
C.K+的物质的量浓度为0.1 mol·L1
D.![]() 的物质的量浓度为0.1 mol·L1
的物质的量浓度为0.1 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓H2SO4 密度1.84 g/mL,物质的量浓度为18.4 mol/L,质量分数为98%,取10 mL浓H2SO4和a mL水混合得物质的量浓度为c mol/L,质量分数为b%。下列组合正确的是
(1)若c=9.2,则a>10 b>49
(2)若c=9.2,则a>10 b<49
(3)若b=49,则a=18.4 c<9.2
(4)若b=49,则a=18.4 c>9.2
A.(1)(3) B.(1)(4) C.(2)(3) D.(2)(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表中短周期的一部分,下列说法正确的是()

A. 非金属性:Y>Z>M
B. 离子半径:M->Z2->Y-
C. ZM2分子中各原子的最外层均满足8电子稳定结构
D. 三种元素中,Y的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
I.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3,MnO4-被还原为Mn2+。
II.在酸性条件下,Ca(NO2)2能将I-氧化为I2,S2O32能将I2还原为I。
III.HNO2是具有氧化性的一元弱酸且AgNO2是一种难溶于水的白色化合物。
(1)兴趣小组同学拟利用铜片和某浓度的硝酸制备物质的量之比为1:1的NO和NO2的混合气体,请写出此反应的离子方程式___________________________;
(2)兴趣小组同学拟利用(1)产生的氮氧化物制备Ca(NO2)2,装置如图。

①装置A中导管末端接一玻璃球的作用是___________________________;
②装置B的作用是________________;
③若现有m mol NO2和n mol NO组成的混合气体进入装置C进行尾气处理,欲用a mol/L NaOH溶液吸收,至少需要a mol/L NaOH溶液的体积为____________升;
(3)兴趣小组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
A.KI(酸性)溶液 B.淀粉溶液
C.Na2S2O3溶液 D.酸性KMnO4溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是____________ (填字母);
②利用Ca(NO2)2的氧化性来测定其纯度,可选择的试剂是____________ (填字母);
(4)兴趣小组同学认为制备的Ca(NO2)2会混有Ca(NO3)2,能用来鉴别二者的试剂(_____)
A.测溶液的PH值 B.加硫酸铁(酸性)溶液
C.加硝酸银溶液 D.加淀粉碘化钾(酸性)溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵是化工、染织、医药、皮革等工业原料。某硫酸工厂利用副产品Y处理尾气SO2得到CaSO4,再与相邻的合成氨工厂联合制备(NH4)2SO4,工艺流程如下:
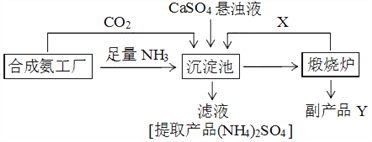
请回答以下问题:
(1)下列有关(NH4)2SO4溶液的说法正确的是_____
A.电离方程式:(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
B.水解离子方程式:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
C.离子浓度关系:c(NH4+)+c(H+)=c(SO42-)+c(OH–)
D.微粒浓度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3H2O)>c(OH–)
(2)硫酸工业中,V2O5作催化剂时发生反应2SO2+ O2 ![]() 2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择下表中最合适的温度和压强分别是__________。该反应420℃时的平衡常数_____520℃时的平衡常数(填“>”、“<”或“=”)。
2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择下表中最合适的温度和压强分别是__________。该反应420℃时的平衡常数_____520℃时的平衡常数(填“>”、“<”或“=”)。
| 1.01×105Pa | 5.05×105Pa | 1.01×106Pa |
420℃ | 0.9961 | 0.9972 | 0.9984 |
520℃ | 0.9675 | 0.9767 | 0.9852 |
620℃ | 0.8520 | 0.8897 | 0.9276 |
(3)在2L密闭容器中模拟接触法制备三氧化硫时,若第12分钟恰好达到平衡,测得生成SO3的物质的量为1.2mol,计算前12分钟用氧气表示反应速率v(O2)为___________。
(4)副产品Y是__。沉淀池中发生的主要反应方程式是___________________。
(5)从绿色化学和资源综合利用的角度说明上述流程的主要优点是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com