
【题目】硫酸铵是化工、染织、医药、皮革等工业原料。某硫酸工厂利用副产品Y处理尾气SO2得到CaSO4,再与相邻的合成氨工厂联合制备(NH4)2SO4,工艺流程如下:
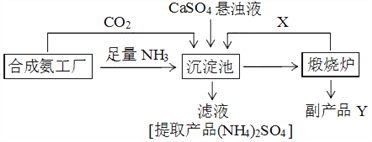
请回答以下问题:
(1)下列有关(NH4)2SO4溶液的说法正确的是_____
A.电离方程式:(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
B.水解离子方程式:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
C.离子浓度关系:c(NH4+)+c(H+)=c(SO42-)+c(OH–)
D.微粒浓度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3H2O)>c(OH–)
(2)硫酸工业中,V2O5作催化剂时发生反应2SO2+ O2 ![]() 2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择下表中最合适的温度和压强分别是__________。该反应420℃时的平衡常数_____520℃时的平衡常数(填“>”、“<”或“=”)。
2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择下表中最合适的温度和压强分别是__________。该反应420℃时的平衡常数_____520℃时的平衡常数(填“>”、“<”或“=”)。
| 1.01×105Pa | 5.05×105Pa | 1.01×106Pa |
420℃ | 0.9961 | 0.9972 | 0.9984 |
520℃ | 0.9675 | 0.9767 | 0.9852 |
620℃ | 0.8520 | 0.8897 | 0.9276 |
(3)在2L密闭容器中模拟接触法制备三氧化硫时,若第12分钟恰好达到平衡,测得生成SO3的物质的量为1.2mol,计算前12分钟用氧气表示反应速率v(O2)为___________。
(4)副产品Y是__。沉淀池中发生的主要反应方程式是___________________。
(5)从绿色化学和资源综合利用的角度说明上述流程的主要优点是________________。
【答案】 BD 420℃、1.01×105Pa > 0.025mol/(L.min) 氧化钙 CaSO4+CO2+2NH3+H2O==CaCO3↓+(NH4)2SO4 产生的CO2循环使用,物质充分利用,副产品有用,无污染性物质产生
【解析】本题分析:本题主要考查对于“工业制备(NH4)2SO4的工艺流程”的评价,涉及硫酸铵的水解等。
(1)A.(NH4)2SO4是强电解质,要用等号表示电离方程式,故A错误;B.正确;C.SO42-带2个单位负电荷,离子的电荷浓度关系:c(NH4+)+ c(H+ ) = 2c(SO42- ) +c(OH–),故C错误; D. NH4+的水解程度小,从(NH4)2SO4的组成可以看出:c(NH4+) >c(SO42-)。溶液中的变化:H2O![]() H++OH-,
H++OH-,![]() +H2O
+H2O![]() NH3 ·H2O+H+,所以 c(H+) > c(NH3H2O )>c(OH–) 。总之,c(NH4+) >c(SO42-) > c(H+) > c(NH3H2O )>c(OH–),故D正确。故选BD。
NH3 ·H2O+H+,所以 c(H+) > c(NH3H2O )>c(OH–) 。总之,c(NH4+) >c(SO42-) > c(H+) > c(NH3H2O )>c(OH–),故D正确。故选BD。
(2)在420℃、1.01×105Pa时,转化率已相当高,没有必要加压,所以最合适的温度和压强分别是420℃、1.01×105Pa。该反应升温平衡左移,所以420℃时的平衡常数大于520℃时的平衡常数。
(3)v(SO3)=(1.2/12/2) mol/(L.min)= 0.05mol/(L.min), v(O2)= v(SO3)/2=0.025mol/(L.min)。
(4)副产品Y是氧化钙。沉淀池中发生的主要反应的化学方程式是CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4。
(5)从绿色化学和资源综合利用的角度,上述流程的主要优点是产生的CO2循环使用,物质充分利用,副产品有用,无污染性物质产生。


科目:高中化学 来源: 题型:
【题目】500 mL含有MgCl2、NaCl、Na2SO4三种物质的混合溶液,已知其中含有Cl为1.8 mol,Na+为2 mol,Mg2+为0.5 mol,则![]() 的物质的量浓度为
的物质的量浓度为
A.0.6 mol /L B.0.7 mol /L C.1.2 mol /L D.1.0 mol /L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大
D. 生成氢气的速率甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应物的物质的量是2.0mol,经过4min后,它的物质的量变成了1.68mol,则在这4min内它的反应速率是( )
A. 无法确定 B. 0.08 molL﹣1min﹣1
C. 0.32 molL﹣1min﹣1 D. 0.06 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.06g某有机物A完全燃烧后,得到1.792 L CO2气体(标况)和0.9gH2O,该有机物对氢气相对密度是53。(第(1)1分(2)(3)各2分共5分)
(1)求该有机物的相对分子质量。
(2)求该有机物的分子式
(3)根据下述实验现象及结论是,确定该有机物的结构简式
①它不能与溴发生反应
②它能使KMnO4酸性溶液褪色
③它能发生硝化反应,当引入1个硝基时,只能得到1种硝基化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的说法正确的是
A. 直径介于1~100纳米之间的微粒称为胶体
B. 当光束通过胶体时,看到的“光柱”是由于光被胶体粒子散射而形成的
C. 胶体的分散质不能透过滤纸的孔隙
D. 溶液是电中性的,胶体是带电的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。

(1)聚合物F的结构简式是____________。
(2)D的结构简式是________________。
(3)B转化为C的化学方程式是_____________________。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是_____________________________________。
(5)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol H2,则该种同分异构体为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是一种利用微生物将废水中的尿素(K2NCONH2)的化学能直接转化为电能,并生成对环境无害物质的装罝;同时利用此装置的电能在铁上镀铜,下列说法中正确的是

A. H+透过质子交换膜由右向左移动
B. 铜电极应与X相连接
C. M电极反应式:H2NCONH2+H2O-6e-== CO2↑+N2↑+6H+
D. 当N电极消耗0.25 mol气体时,铁电极增重16 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需要0.2 mol·L1CuSO4溶液250 mL,实验室除蒸馏水外还提供蓝色胆矾晶体(CuSO4·5H2O)和4 mol·L1CuSO4溶液两种试剂以配制该溶液。
(1)无论采用何种试剂进行配制,除烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是___________,在使用该仪器前必须进行的操作是______________________。
(2)若用胆矾晶体进行配制,需用托盘天平称取CuSO4·5H2O的质量为___________ g;如果用4 mol/L的CuSO4溶液稀释配制,需用量筒量取___________mL 4 mol/LCuSO4溶液。
(3)用4 mol/L的硫酸铜溶液稀释配制溶液所需的实验步骤有:
a.往烧杯中加入约100 mL水进行初步稀释,冷却至室温
b.用量筒量取一定体积4 mol/L的硫酸铜溶液于一烧杯中
c.计算所需4 mol/L硫酸铜溶液的体积
d.盖好瓶塞,反复上下颠倒摇匀后,将溶液转存于试剂瓶中
e.加水至液面离容量瓶刻度线1~2 cm处改用胶头滴管进行定容
f. 洗涤烧杯和玻璃棒2~3次并将洗涤液注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀
g. 将溶液转移入容量瓶
其中正确的操作顺序为______________________。
(4)指出配制过程中的以下情形对所得溶液浓度的影响(填“偏高”“偏低”或“无影响”)。
①d步骤摇匀后,发现液面低于刻度线,再加水至刻度线:___________。
②e步骤中,俯视刻度线:___________。
③g步骤前,容量瓶未干燥,有少量蒸馏水:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com