
【题目】某化学反应:3A(g)![]() 2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:
2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:
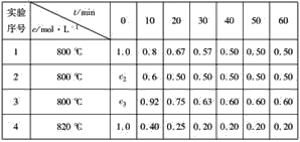
根据上述数据,完成下列填空:
(1)c2=______ mol·L-1。
(2)在实验1和2中,有一个实验使用了催化剂,根据表中数据判断,使用催化剂的实验为_______________,理由是__________________________
(3)求在实验4中,反应在0~10 min内反应物A的平均反应速率为______________。
【答案】1.0 实验2 达平衡时2组的时间较短,所以只能是加入催化剂 0.06mol/(Lmin)
【解析】
(1)根据实验1、2数据、利用影响速率的因素来分析;
(2)根据催化剂能加快化学反应,续短到达平衡的时间,平衡不移动;
(3)根据V=![]() 及表格中的数据来计算反应速率;
及表格中的数据来计算反应速率;
(1)根据实验1、2数据分析,温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0molL-1,
故答案为:1.0;
(2)温度相同,达平衡后A的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂,
故答案为:实验2;达平衡时2组的时间较短,所以只能是加入催化剂;
(3)v(A)=![]() =
=![]() =0.06mol/(Lmin),
=0.06mol/(Lmin),
故答案为:0.06mol/(Lmin)。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定条件下能大量共存的是( )
A.使甲基橙呈黄色的溶液中:Na+、Fe3+、Cl-、CO32-
B.使pH 试纸显蓝色的溶液中:K+、Na+、NO3-、SO42-
C.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO3-
D. ![]() = 1×1012的溶液中:Fe3+、K+、CO32-、ClO-
= 1×1012的溶液中:Fe3+、K+、CO32-、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fex(OH)y(SO4)z](其中Fe元素为+ 3价)是一种新型高效絮凝剂。一种利用废铁屑(含Fe和少量Al2O3、Fe2O3)生产碱式硫酸铁的工艺流程如下:
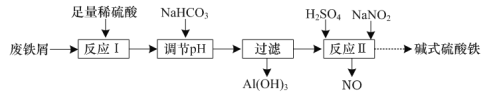
下列说法正确的是
A.x、y、z一定符合关系式:x=y=z
B.“过滤”所得滤液中只含溶质FeSO4
C.“反应Ⅰ”中包含的反应类型有置换反应、化合反应和复分解反应
D.在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若有11.2 L(标准状况)的O2参与反应,则相当于节约2 mol NaNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃条件下,向![]() 的盐酸中不断通
的盐酸中不断通![]() ,该过程中水电离出的氢离子浓度
,该过程中水电离出的氢离子浓度![]() 水
水![]() 与通入
与通入![]() 的物质的量关系如图,下列说法不正确的是( )。
的物质的量关系如图,下列说法不正确的是( )。
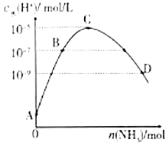
A.![]() 点的纵坐标为
点的纵坐标为![]()
B.![]() 点溶液中
点溶液中![]()
C.![]() 点溶液中
点溶液中![]()
D.![]() 点溶液的
点溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下图所示的操作步骤,完成Ba(OH)2·8H2O与氯化铵晶体反应的实验。
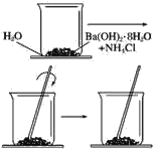
回答下列问题
(1)实验过程中观察到的现象是________________________。
(2)写出该反应的化学方程式___________________。
(3)该反应是放热反应还是吸热反应________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一种硫化矿(含45%SiO2、20.4% Al2O3、30%FeS和少量GeS2等)制取盆景肥料NH4Fe(SO4)2及铝硅合金材料的工艺流程如下 :
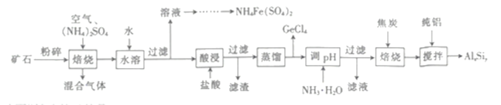
(1)“矿石”粉碎的目的是_____________________ 。
(2)“混合气体”经过水吸收和空气氧化能再次利用。
①“焙烧”时,GeS2发生反应的化学方程式为____________________。
②“混合气体”的主要成分是_______________ (填化学式).
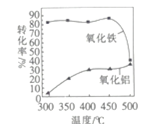
③FeS焙烧产生的Fe2O3会与(NH4)2SO4反应生成NH4Fe(SO4)2,该反应的化学方程式为_______________。 Al2O3也能发生类似反应.这两种氧化物转化为硫酸盐的转化率与温度的关系如图,上述流程中最适宜的“焙烧” 温度为_____________________。
(3)GeCl4的佛点低,可在酸性条件下利用蒸馏的方法进行分离,酸性条件的目的是_________。
(4)用电解氧化法可以增强合金 AlxSiy的防腐蚀能力,电解后在合金表面形成致密、耐腐蚀的氧化膜(主要成分为Al2O3), 电解质溶液为 H2SO4-H2C2O4混合溶液,阳极的电极反应式为______________________。
(5)假设流程中SiO2 损失了20%,Al2O3 损失了25%,当投入1 t硫化矿,加入了54kg纯铝时,铝硅合金中x:y=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸件废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水祥品分别进行如图所示①~④四个实验。下列推断正确的是
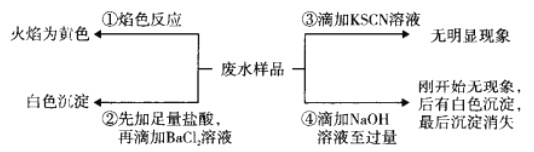
A. 废水含有Na+,不含K+
B. 废水含有SO42-和CO32-
C. 废水不含Fe3+,可能含Fe2+
D. 废水一定含有Na+、Al3+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如表所示。
化学反应 | 化学平衡常数 | 温度(℃) | ||
500 | 700 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) | K3 | |||
(1)下列措施能使反应③的平衡体系中![]() 增大的是__
增大的是__
A.将H2O(g)从体系中分离出去 B.恒容时充入He(g),使体系压强增大
C.升高温度 D.恒容时再充入1molH2(g)
(2)T℃时,反应③在恒容密闭容器中充入1molCO2和nmolH2,混合气体中CH3OH的体积分数与氢气的物质的量的关系如图1所示。图1中A、B、C三点对应的体系,CO2的转化率最大的是___(填字母)。
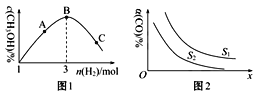
(3)工业上也用合成气(H2和CO)合成甲醇,反应为2H2(g)+CO(g)![]() CH3OH(g) ΔH<0,在10L的恒容密闭容器中充入H2和C物质的量比为2:1,测得CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) ΔH<0,在10L的恒容密闭容器中充入H2和C物质的量比为2:1,测得CO的平衡转化率与温度、压强的关系如图2所示。
①图2中S代表的物理量是___。
②300℃时,氢气的物质的量随时间变化如表所示
反应时间/min | 0 | 1 | 4 | 5 |
H2/mol | 8 | 5.4 | 4 | 4 |
在该温度下,上述反应的平衡常数为___。若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH,保持温度和容器体积不变,则平衡会___(填“正向移动”“逆向移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种太阳能驱动从海水中提取金属锂的装置,示意图如图所示。该装置工作时,下列说法正确的是
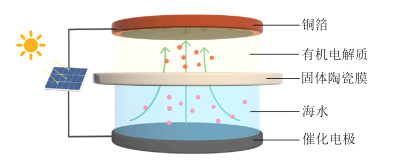
A.铜箔上的电势比催化电极上的高
B.海水的pH变大
C.若转移1mol电子,理论上铜箔增重7g
D.固体陶瓷膜可用质子交换膜代替
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com