
【题目】按照下图所示的操作步骤,完成Ba(OH)2·8H2O与氯化铵晶体反应的实验。
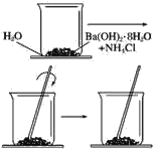
回答下列问题
(1)实验过程中观察到的现象是________________________。
(2)写出该反应的化学方程式___________________。
(3)该反应是放热反应还是吸热反应________。
【答案】产生刺激性气味气体,用手触摸烧杯有冰凉的感觉,玻璃片和烧杯黏到一起,烧杯内反应物呈糊状 Ba(OH)2·8H2O+2NH4Cl=2NH3↑+ BaCl2+10H2O 吸热反应
【解析】
(1)产生刺激性气味气体,用手触摸烧杯有冰凉的感觉,玻璃片和烧杯黏到一起,烧杯内反应物呈糊状;
(2) Ba(OH)2·8H2O与NH4Cl发生复分解反应;
(3) 烧杯与玻璃片中间的水温度降低结冰使玻璃片黏在烧杯上,所以反应为吸热反应;
(1)由于反应生成了氨气,产生刺激性气味气体,反应吸热用手触摸烧杯有冰凉的感觉,反应吸热使烧杯与玻璃片间的水凝固,故玻璃片和烧杯黏到一起,反应生成了氯化钡,故烧杯内反应物呈糊状。故答案为产生刺激性气味气体,用手触摸烧杯有冰凉的感觉,玻璃片和烧杯黏到一起,烧杯内反应物呈糊状,
故答案为:产生刺激性气味气体,用手触摸烧杯有冰凉的感觉,玻璃片和烧杯黏到一起,烧杯内反应物呈糊状;
(2)根据实验现象,写出化学方程式Ba(OH)2·8H2O+2NH4Cl=2NH3↑+ BaCl2+10H2O,
故答案为:Ba(OH)2·8H2O+2NH4Cl=2NH3↑+ BaCl2+10H2O;
(3)烧杯与玻璃片中间的水温度降低结冰使玻璃片黏在烧杯上,所以反应为吸热反应,
故答案为:吸热反应。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】某同学通过以下装置测定M样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质量均为m g的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL和V2 mL(已折算到标准状况下)。
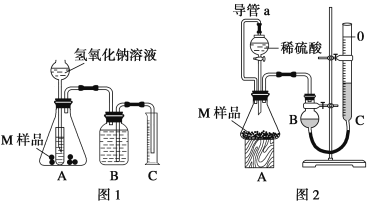
(1)写出实验1中可能发生反应的离子方程式:____________。
(2)该实验需要0.50 mol·L-1的NaOH溶液480 mL,请回答下列问题:
①配制时应用托盘天平称量______g NaOH,应选择________ ml容量瓶。
②配制NaOH溶液时,NaOH固体中含有Na2O杂质会导致所配溶液浓度________。(填“偏大”、“偏小”或“无影响”)。
(3)该实验中所用稀硫酸是用98%的浓硫酸(ρ=1.84g/cm3)配制的,则该浓硫酸的物质的量浓度是_______。
(4)对于实验2,读数时冷却至室温除视线平视外,还应进行的操作是: ___________。
(5)实验2中导管a的作用_________。
(6)M样品中铜的质量的数学表达式为(用V1和V2 表示):_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在目前市面上防护新冠病毒的消毒剂中,二氧化氯消毒剂是相对高效更安全的产品。二氧化氯的熔点为![]() ,沸点为
,沸点为![]() ,易溶于水但不与水反应,在生产和使用时必须用空气、二氧化碳、氮气等“惰性”气体进行稀释,但温度过高、气相浓度过大时均易发生爆炸。工业上用稍潮湿的
,易溶于水但不与水反应,在生产和使用时必须用空气、二氧化碳、氮气等“惰性”气体进行稀释,但温度过高、气相浓度过大时均易发生爆炸。工业上用稍潮湿的![]() 和草酸在
和草酸在![]() 时反应制得(如下图所示),在
时反应制得(如下图所示),在![]() 装置内用冷水吸收
装置内用冷水吸收![]() 。
。
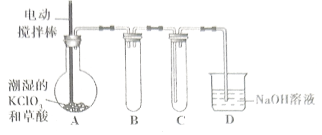
(1)装置A中发生反应:![]() (未配平),当生成
(未配平),当生成![]() 时,同时产生标准状况下
时,同时产生标准状况下![]() 的体积是______
的体积是______![]() 。
。
(2)实验时,对A装置进行加热操作还需要的玻璃仪器有酒精灯、_____、_______。
(3)本实验哪些设计从实验安全角度考虑______。(填2条)
(4)装置D中,![]() 与
与![]() 溶液反应可生成两种盐,且二者物质的量之比为
溶液反应可生成两种盐,且二者物质的量之比为![]() ,其中一种是
,其中一种是![]() 。
。
①写出![]() 与
与![]() 溶液反应的离子方程式_______。
溶液反应的离子方程式_______。
②已知饱和![]() 溶液随温度变化情况如下图:
溶液随温度变化情况如下图:
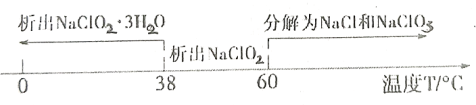
从![]() 溶液中获得
溶液中获得![]() 晶体的操作步骤为:减压蒸发结晶→______→______→
晶体的操作步骤为:减压蒸发结晶→______→______→![]() 干燥,得到成品。(选择合适的操作编号填空)
干燥,得到成品。(选择合适的操作编号填空)
A.冷却到室温后,过滤 B.趁热过滤 C.常温洗涤 D.冰水洗涤 E.![]() 的温水洗涤
的温水洗涤
采用减压蒸发的原因是_____。
(5)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,![]() 、
、![]() 、
、![]() 三种消毒杀菌剂的消毒效率由小到大的顺序是____(填化学式)。
三种消毒杀菌剂的消毒效率由小到大的顺序是____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 资源化利用的方法之一是合成二甲醚(
资源化利用的方法之一是合成二甲醚(![]() 简写做
简写做![]() )。
)。![]() 催化加氢法合成
催化加氢法合成![]() ,其过程中主要发生下列反应:
,其过程中主要发生下列反应:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
其中,反应Ⅱ分以下两步完成,请写出反应Ⅳ的热化学方程式。
反应Ⅲ:![]()
![]()
反应Ⅳ:___________。
⑴反应Ⅳ的热化学方程式为________。
⑵在![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 的平衡转化率和平衡时
的平衡转化率和平衡时![]() 、
、![]() 的选择性随压强或温度的变化见下图。已知:
的选择性随压强或温度的变化见下图。已知:
![]() 的选择性
的选择性![]() ;
;
![]() 的选择性
的选择性![]()
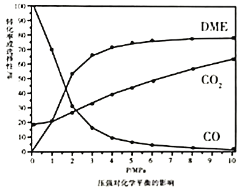
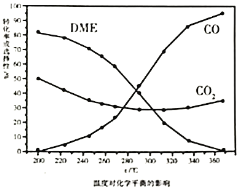
①依据图像中的数据分析,提高平衡时![]() 的选择性应当选择的条件为________。
的选择性应当选择的条件为________。
A 高温高压 B 低温低压 C 高温低压 D 低温高压
按照温度对化学平衡的影响图像分析温度低于300℃,![]() 平衡转化率随温度升高而降低的原因是_______。
平衡转化率随温度升高而降低的原因是_______。
②某温度和压强下,起始投入![]() 与足量
与足量![]() 发生反应,达到平衡时
发生反应,达到平衡时![]() 的转化率为40%,部分物质的物质的量如下表:
的转化率为40%,部分物质的物质的量如下表:
|
|
|
|
|
|
计算平衡时![]() 的选择性为________,反应Ⅳ的化学平衡常数为________。
的选择性为________,反应Ⅳ的化学平衡常数为________。
⑶经研究发现,在不同反应条件下反应相同时间(未平衡)测定发现,体系中![]() 的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
⑷![]() ,投料比为
,投料比为![]() 时进行反应,
时进行反应,![]() 的浓度随时间变化如下图所示,则下列说法正确的为________。
的浓度随时间变化如下图所示,则下列说法正确的为________。
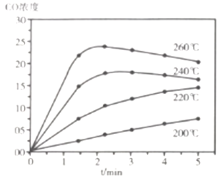
A 在![]() 范围内,反应Ⅰ的速率随温度升高而增大
范围内,反应Ⅰ的速率随温度升高而增大
B 200℃条件下,随反应时间的延长,![]() 的浓度始终增大
的浓度始终增大
C 260℃条件下,随反应时间的延长,![]() 的浓度先增大后减小最终不变
的浓度先增大后减小最终不变
D 260℃条件下,![]() 后
后![]() 的浓度减小是因为随时间推移反应Ⅱ的进行使体系中
的浓度减小是因为随时间推移反应Ⅱ的进行使体系中![]() 浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使
浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使![]() 浓度逐渐下降
浓度逐渐下降
查看答案和解析>>
科目:高中化学 来源: 题型:
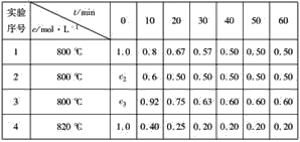
【题目】某化学反应:3A(g)![]() 2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:
2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:
根据上述数据,完成下列填空:
(1)c2=______ mol·L-1。
(2)在实验1和2中,有一个实验使用了催化剂,根据表中数据判断,使用催化剂的实验为_______________,理由是__________________________
(3)求在实验4中,反应在0~10 min内反应物A的平均反应速率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)![]() 2C(g) △H>0,其他条件不变,只有温度改变时,某量随温度变化的关系如图所示。则下列说法正确的是
2C(g) △H>0,其他条件不变,只有温度改变时,某量随温度变化的关系如图所示。则下列说法正确的是
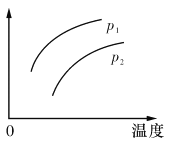
A.P1>P2,纵坐标可表示A的质量分数
B.P1<P2,纵坐标可表示C的质量贫数
C.P1>P2,纵坐标可表示混合气体的平均摩尔质量
D.P1<P2,纵坐标可表示A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
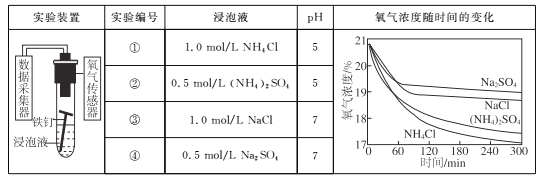
下列说法不正确的是
A. 上述正极反应均为O2+4e-+2H2O=4OH-
B. 在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C. 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D. 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知6.2克某有机物在氧气中完全燃烧,其产物(100 ℃)依次通过盛有浓硫酸的洗气瓶、盛有碱石灰的干燥管全部被吸收后,洗气瓶的质量增加5.4克,干燥管的质量增加8.8克。
(1)计算确定该有机物的最简式。_________________
(2)相同条件下,若该有机物蒸气相对氢气的密度为31,计算确定该有机物的分子式。_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com