
 mZ(气)+nR(气),达平衡时,Z的体积分数为φ1,维持温度不变,若把3 molX和2molY放入另一体积相同的密闭容器,达平衡时,Z的体积分数为φ2,则φ1与φ2的关系为
mZ(气)+nR(气),达平衡时,Z的体积分数为φ1,维持温度不变,若把3 molX和2molY放入另一体积相同的密闭容器,达平衡时,Z的体积分数为φ2,则φ1与φ2的关系为[ ]
科目:高中化学 来源: 题型:阅读理解


| ||
| ||
 2SO3(g);△H=-196.6KJ?mol-1.平衡时容器内气体压强为起使时的90%.
2SO3(g);△H=-196.6KJ?mol-1.平衡时容器内气体压强为起使时的90%.查看答案和解析>>
科目:高中化学 来源: 题型:
| 6 |
| 7 |
| 7 |
| 6 |
| 7 |
| 6 |
| 1 |
| 6 |
| 108 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
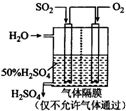 硫酸被称为“工业之母”,足见其在工业生产中的重要地位.利用催化氧化反应将SO2转化为SO3是工业生产硫酸的关键步骤.一定温度下,向一个带活塞的体积为2L的密闭容器中充入2.0mol SO2(g)和1.0mol O2(g),发生反应:SO2(g)+
硫酸被称为“工业之母”,足见其在工业生产中的重要地位.利用催化氧化反应将SO2转化为SO3是工业生产硫酸的关键步骤.一定温度下,向一个带活塞的体积为2L的密闭容器中充入2.0mol SO2(g)和1.0mol O2(g),发生反应:SO2(g)+| 1 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com