
【题目】甲、乙、丙三种物质之间有如下图所示的转化关系: 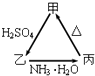
(1)若甲是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是(填化学式). 写出反应的化学方程式
①甲→乙 .
②乙→丙 .
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是(填化学式).写出反应的离子方程式: ①甲→乙 .
②乙→丙 .
【答案】
(1)Al2O3;Al2O3+3H2SO4=Al2(SO4)3+3H2O;Al2(SO4)3+6NH3?H2O=2Al(OH)3↓+3(NH4)2SO4
(2)Fe2O3;Fe2O3+6H+=Fe3++3H2O;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
【解析】解:(1)若甲是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是Al2O3 , 乙是Al2(SO4)3 , 丙是Al(OH)3 , 甲→乙的反应方程式为:Al2O3+3H2SO4=Al2(SO4)3+3H2O,乙→丙的反应方程式为:Al2(SO4)3+6NH3H2O=2Al(OH)3↓+3(NH4)2SO4 , 所以答案是:Al2O3;Al2O3+3H2SO4=Al2(SO4)3+3H2O;Al2(SO4)3+6NH3H2O=2Al(OH)3↓+3(NH4)2SO4;(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲是 Fe2O3 , 乙是Fe2(SO4)3 , 丙是Fe(OH)3 . 甲→乙的离子方程式为:Fe2O3+6H+=Fe3++3H2O,乙→丙的离子方程式为:Fe3++3NH3H2O=Fe(OH)3↓+3NH4+ , 所以答案是:Fe2O3;Fe2O3+6H+=Fe3++3H2O;Fe3++3NH3H2O=Fe(OH)3↓+3NH4+ .


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物.试推断: 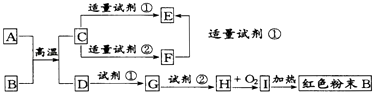
(1)写出物质的化学式:A:B:C:Ⅰ: .
(2)向F中逐滴滴加试剂①的现象为 .
(3)写出下列反应的方程式: C→E的离子方程式
C→F的离子方程式
G→H的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2 . 在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g.下列有关说法不正确的是( )
A.Cu与Cu2O的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO 、CO2 、N2O4三种气体分别都含有0.5 mol氧原子,三种气体的物质的量之比为( )
A. 1:1:2 B. 4:2:1 C. 1:1:1 D. 1:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O反应中,
(1)氧化剂是__,氧化产物是__.
(2)写出该反应的离子方程式.__.
(3)若有219gHCl参加反应,产生Cl2的体积(标况下)为__ L,转移电子__ mol.
(4)Cl2有毒,多余的Cl2通常用氢氧化钠溶液吸收,反应的离子方程式为:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲和乙的某些性质如表所示:
物质 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 水中的溶解性 |
甲 | -98 | 37.5 | 0.93 | 可溶 |
乙 | -48 | 95 | 0.90 | 可溶 |
现有甲和乙的混合物,进行分离时,可采用的方法是( )
A.过滤B.蒸发C.蒸馏D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e﹣、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系: 
①均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;
②均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.请回答下列问题:
(1)化合物甲的电子式为 .
(2)F元素在周期表中的位置稳定性:A2CA2E(填“大于”“小于”“等于”).
(3)均含有D元素的乙与丁在溶液中发生反应的离子方程式
(4)丙、丁分别是含F元素的简单阳离子,检验含丙、丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:
(5)已知常温下化合物FE的Ksp=6×10﹣18 mol2L﹣2 , 常温下将1.0×10﹣5molL﹣1的Na2E溶液与含FSO4溶液按体积比3:2混合,若有沉淀F E生成,则所需的FSO4的浓度要求 . (忽略混合后溶液的体积变化).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com