
【题目】为测定石灰石样品中碳酸钙(合SiO2杂质)的含量。现利用如图所示装置进行实验,充分反应后,测定装置C中生成的BaCO3沉淀质量。下列说法正确的是

A. 装置A中药品应为浓硫酸
B. 在B~C之间应增添盛有饱和NaHCO3溶液的洗气装置,以除去氯化氢气体
C. 只要测定装置C在吸收CO2前后的质量差,也可以确定碳酸钙的质量分数
D. 为了测得C中生成的沉淀质量,需经过过滤、洗涤、干燥、称量等操作
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】关于A(g)+2B(g)![]() 3C(g)的化学反应,下列表示的反应速率最快的是( )
3C(g)的化学反应,下列表示的反应速率最快的是( )
A. v(A)=0.6 mol/(L·min) B. v(B)=0.3 mol/(L·s)
C. v(C)=0.9 mol/(L·min) D. v(C)=1.2 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于细胞中元素的叙述,错误的是
A. 硅藻和水稻细胞中Si元素的含量较多
B. 细胞中含量最多的四种元素是C、O、H和N
C. 组成细胞的化学元素没有一种为细胞特有
D. 活细胞中含量最多的化学元素是C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( ) 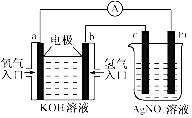
A.该装置中Pt极为阳极
B.当c极的质量变化了2.16g时,a极上消耗的O2在标准状况下的体积为1.12L
C.该装置中b极的电极反应式是:H2+2OH﹣﹣2e﹣=2H2O
D.该装置中a极为正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产纯碱的工艺流程示意图如下:
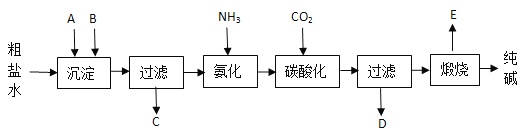
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A_____________________ B_____________________。
(2)实验室提纯粗盐的实验操作依次为:_________
取样→________→ 沉淀 →________→______ → 冷却结晶 → _______ → 烘干 。
(3)工业生产纯碱的工艺流程中,先通氨气,再通二氧化碳的原因是________________。
(4)碳酸化时产生的现象是____________________________________,碳酸化后过滤,滤液D最主要的成分是____________(填写化学式)。
(5)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数(已知:样品质量为m1,加热后固体质量为m2),纯碱中碳酸氢钠的质量分数可表示为W(NaHCO3)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年2月18日,英国食品标准局向英国民众发出警告,公布了359种食品中含有可能致癌的“苏丹红一号”,一时间“苏丹红一号”成为媒体关注的焦点。“苏丹红一号”的结构简式如图:下列关于苏丹红一号的有关叙述正确的是
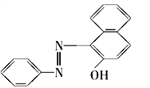
A. 苏丹红一号的分子式C18H12N2O
B. 苏丹红一号的相对分子质量是248 g·mol-1
C. 苏丹红一号属于烃
D. 苏丹红一号能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)石油分馏可以得到汽油。汽油是低沸点的烷烃的混合物,其分子中的碳原子数一般在C5~C12范围内,如戊烷,其分子式为________,符合这个分子式的结构有_____种,其中某种结构的一氯代物只有一种,写出符合这种条件的该烷烃的结构简式__________。
(二)石油裂解可获得A。已知A在通常状况下是一种相对分子量为28的气体,A通过加聚反应可以得到F,F常作为食品包装袋的材料。有机物A、B、C、D、E、F有如下图的关系。

已知: 。
。
(1)A的分子式为________,F的名称______________。
(2)写出指定反应的化学方程式,并注明反应类型
反应 | 反应方程式 | 反应类型 |
① | _______ | _______ |
② | _______ | _______ |
③ | _______ | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期元素有许多重要用途。
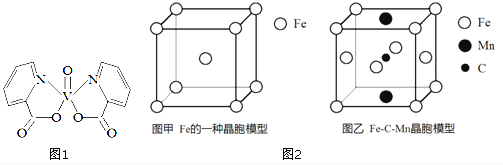
I.研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。
(1) 基态V元素的价层电子轨道表示式为___________,分子中非金属元素电负性由大到小的顺序为______________。
(2) 分子中采取sp2杂化的原子有_________,1mol 分子中含有配位键的数目是______。
(3) 该物质的晶体中除配位键外,所含微粒间作用力的类型还有______ (填序号)。
a. 金属键 b.极性键 c.非极性键 d.范德华力 e. 氢键
II.Fe 与C、Mn等元素可形成多种不同性能的合金。
(4) 图2-甲是Fe的一种晶胞,晶胞中Fe 的堆积方式为________,己知该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的边长为__________cm。
(5) 图2-乙是Fe-C-Mn 合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe 的个数为___,该合金的化学式为__________。
【答案】  O>N>C>H C、N 2NA bcd 体心立方密堆积
O>N>C>H C、N 2NA bcd 体心立方密堆积 ![]() 4 Fe23Mn8C8
4 Fe23Mn8C8
【解析】I. (1). V是23号元素,其价层电子排布式为3d34s2,价层电子轨道表示式为 ,由图1可知,该配合物中含有N、O、C、H四种非金属元素,由元素周期律可知,这四种元素的非金属性O>N>C>H,非金属性越强,电负性越大,则电负性由大到小的顺序为:O>N>C>H,故答案为:
,由图1可知,该配合物中含有N、O、C、H四种非金属元素,由元素周期律可知,这四种元素的非金属性O>N>C>H,非金属性越强,电负性越大,则电负性由大到小的顺序为:O>N>C>H,故答案为: ;O>N>C>H;
;O>N>C>H;
(2). 由图1可知,该分子中的C原子和N原子的σ键数均为3且没有孤电子对,所以C原子和N原子的杂化轨道数目均为3,采取sp2杂化,由图1可知,V与N原子之间形成配位键,1个分子中含有2个配位键,则1mol分子中含有2mol配位键,数目为2NA,故答案为:C、N;2NA;
(3). 该物质是电中性分子,分子之间存在范德华力,由图1可知,该物质的晶体中除配位键外,分子内的不同非金属原子之间形成极性共价键,同种非金属原子之间形成非极性共价键,不存在金属键和氢键,故答案为:bcd;
II. (4). 由Fe的晶胞结构示意图可知,晶胞中Fe的堆积方式为体心立方密堆积,晶胞中Fe原子的个数为:8×![]() +1=2,则晶胞的质量为:
+1=2,则晶胞的质量为:![]() ×56g,设晶胞的棱长为x cm,则
×56g,设晶胞的棱长为x cm,则![]() ×56g=ρg·cm-3×(x cm)3,解得x=
×56g=ρg·cm-3×(x cm)3,解得x=![]() cm,故答案为:体心立方密堆积;
cm,故答案为:体心立方密堆积;![]() ;
;
(5). 由图乙可知,体心的C原子与面心的Fe原子距离最近,则与C原子等距紧邻的Fe原子个数为4,该晶胞中Fe原子个数为7×![]() +4×
+4×![]() =
=![]() ,C原子个数为1,Mn原子数目为2×
,C原子个数为1,Mn原子数目为2×![]() =1,则Fe、Mn、C原子数目之比为23:8:8,化学式为:Fe23Mn8C8,故答案为:4;Fe23Mn8C8。
=1,则Fe、Mn、C原子数目之比为23:8:8,化学式为:Fe23Mn8C8,故答案为:4;Fe23Mn8C8。
点睛:本题主要考查物质结构和性质,涉及电子排布式、电负性、杂化方式、配合物、晶胞结构和有关计算,试题难度不大。本题的易错点是第(5)小题,在利用均摊法计算晶胞中原子个数时,要注意该晶体有缺陷,即有一个顶点未排列Fe原子。
【题型】综合题
【结束】
12
【题目】香料G的一种合成工艺如下图所示。

A 的分子式为C5H8O其核磁共振氢谱显示有两种峰。其峰面积之比为1: 1.
已知:CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
请回答下列问题:
(1)G中含氧官能团的名称为_______,B生成C的反应类型为_________。
(2)A的结构简式为_______。
(3)写出下列转化的化学方程式:D→E_____________________
(4)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_______。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有____种。(不考虑立体异构),其中核磁共振氢谱显示5组峰的结构简式为_______、________。
①能发生银镜反应 ②能与溴的四氯化碳溶液加成 ③苯环上有2个取代基
(6) 以2-丙醇和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)__________。
请用以下方式表示: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如图装置合成正丁醛.发生的反应如下:![]() 。
。

反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(gcm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
已知:醛基可被酸性Na2Cr2O7氧化。
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加水30mL溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以上的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由__________________。
(2)加入沸石的作用是______________,若加热后发现未加入沸石,应采取的正确措施是______________________________。
(3)上述装置图中,B仪器的名称是_____________,D仪器的名称是_______________。
(4)反应温度应保持在90~95℃,其原因是___________________________。
(5)温度计C1的作用_________________,C2的作用_______________。
(6)本实验中,正丁醛的产率为_________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com