
下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 明矾水解时产生具有吸附性的胶体粒子 | 明矾可作自来水消毒 |
B | Fe3+有氧化性 | FeCl3溶液可用于溶解回收旧电路板 中的铜 |
C | NH4Cl受热分解 | 加热可将Ca(OH)2和NH4Cl固体混合物分离 |
D | SO2具有氧化性 | SO2可用于漂白纸浆 |
B
【解析】
试题分析:A项明矾净水是利用铝离子水解生成胶体,表面积大吸附溶液中杂质达到净水的目的,但明矾只能用于净水,不能杀菌消毒,故A项错误;B项Fe3+有氧化性可将Cu氧化为铜离子,故可用FeCl3溶液溶解回收旧电路板中的铜,故B项正确;C项NH4Cl受热分解,但加热可将Ca(OH)2和NH4Cl固体会产生氨气、氯化钙和水,是实验室制备氨气的反应原理,故加热Ca(OH)2和NH4Cl不能将混合物分离,故C项错误;D项SO2中S为+4价,中间价态,故既有氧化性又有还原性,SO2可用于漂白纸浆,是利用了SO2的还原性,与有机色素络合为无色物质,两者没有联系,故D项错误;本题选B。
考点:物质性质及应用。
考点分析: 考点1:氧化还原反应 考点2:盐类水解 考点3:镁铝及其化合物 考点4:铁及其化合物 考点5:铜及其化合物 考点6:氮族元素 考点7:氧族元素 试题属性

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.尽管NO2能与水反应生成硝酸,但 NO2不属于酸性氧化物
B.某气体只含N、H 两种元素,且质量之比为14︰3,则该气体一定为纯净物
C.氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应
D.Na2O 溶于水所得溶液能导电,据此可判断 Na2O属于电解质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省稳派教育高三一轮复习质量检测理科综合化学试卷(解析版) 题型:填空题
以甲烷为初始原料制取氢气,是一项比较成熟的技术,下面是制取氢气的流程图,根据信息回答下列问题:

(1)阶段I发生的反应为CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
①已知在“水碳比”[ ]等于3时测得温度(T )和压强(p)对上述反应的影响如图所示。则升高温度,该反应的平衡常数K_______(填“增大”、“减小”或“不变”),据图可知p1_________(填“>”、“<”或“=”)p2。
]等于3时测得温度(T )和压强(p)对上述反应的影响如图所示。则升高温度,该反应的平衡常数K_______(填“增大”、“减小”或“不变”),据图可知p1_________(填“>”、“<”或“=”)p2。

②将等物质的量的甲烷和水蒸气充入1L恒容密闭容器中,发生上述反应,某温度下反应达到平衡,平衡常数K=27,此时测得一氧化碳的物质的量为0.10 mol,则甲烷的平衡转化率为____________。
(2)阶段Ⅱ发生的反应为CO(g)+ H2O(g) CO2(g)+ H2 (g),T1温度时,向2L的恒容密闭容器中通入一定量的CO和H2O(g),反应过程中测得部分数据如下表所示(表中t1<t2):
CO2(g)+ H2 (g),T1温度时,向2L的恒容密闭容器中通入一定量的CO和H2O(g),反应过程中测得部分数据如下表所示(表中t1<t2):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
①保持T1温度不变,若向原容器中通入0.60 rnol CO和1.20 mol H2O(g),则达到平衡后n(CO2)=____。
②若达到平衡后,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是________。
a.CO的转化率将增大
b.H2O(g)的体积分数将增大
c.气体的密度将不变
d.化学平衡常数将增大
e.因混合气体总体积不变,故混合气体的总物质的量不变
(3)储氢问题是安全利用氢能的关键,某合金是一种能够吸收氢气的神奇材料,已知一定条件下1 cm3的该合金最多可吸收6.02×1022个氢原子,液态氢气的密度为0.07 g·cm-3,则相同体积的该合金和液态氢的含氢量之比为_________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省中山市高三下学期第二次模拟考试理科综合化学试卷(解析版) 题型:选择题
已知:Fe2O3 (s)+ C(s)=
C(s)=  CO2(g)+2Fe(s) △H=234.1kJ·mol-1
CO2(g)+2Fe(s) △H=234.1kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 则2Fe(s)+ O2(g ) = Fe2O3(s) 的△H是
O2(g ) = Fe2O3(s) 的△H是
A.-824.4kJ·mol-1 B.-627.6kJ·mol-1
C.-744.7kJ·mol-1 D.-169.4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省江门市高三3月模拟考试理科综合化学试卷(解析版) 题型:选择题
如表所示的五种元素中,甲、乙、丙、丁为短周期元素,其中乙是地壳中含量最多的元素。下列说法正确的是
甲 | 乙 | ||
丙 | 丁 | ||
戊 |
A.原子半径:甲>乙
B.丁和戊的原子核外电子数相差8
C.最高价氧化物对应的水化物的酸性:丙>丁
D.甲的单质在空气中燃烧生成只含共价键的化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期3月月考理综化学试卷(解析版) 题型:实验题
(14分)某研究性学习小组研究HNO3的氧化性,设计了如下实验:
在盛有新制FeSO4溶液的试管中滴入2滴KSCN溶液,观察现象,然后再滴入几滴浓HNO3,溶液的颜色变红,但是将红色溶液放置一会儿则发现溶液由红色快速变为蓝色,并产生红棕色气体,这一奇特现象激起了同学的好奇心与求知欲望,对此现象设计了探究性实验。
(1)甲同学认为是溶液中的Fe2+的干扰造成的,大家经过理性分析,认为可以排除Fe2+的干扰,理由是______________________________________________。
(2)乙同学认为红色消失,说明Fe(SCN)3被破坏,红棕色NO2说明了某些离子与HNO3发生了氧化还原,推测可能是KSCN与HNO3作用。KSCN溶液是一种无色液体,根据C、S、N的原子结构和共价键的相关知识推测SCN-中碳原子的杂化轨道类型是_______杂化。
(3)根据乙同学的观点,设计了实验方案1,往浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深红色,突然剧烈反应产生大量气泡,放出红棕色气体,而溶液红色消失变为浅绿色,溶液温度升高;继续滴入KSCN,溶液变为浅蓝色,最后变成无色。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种非极性气体;向反应后的溶液中加入BaCl2溶液产生白色沉淀,写出向浓HNO3中滴入KSCN的离子方程式______________________________。
(4)丙同学认为SCN-的性质还可进一步探究,设计了方案2,向Fe(SCN)3中分别滴加过量的氯水、溴水,溶液的红色均消失变为黄色,而加入碘水时溶液的颜色基本不变。丙同学的设计意图是____________。
(5)通过本次探究,可以得出以下结论:
a、用SCN-间接检验Fe2+时应注意__________;
b、与SCN-反应使溶液变红的______是Fe3+。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期3月月考理综化学试卷(解析版) 题型:选择题
下列分类正确的是
酸性氧化物 | 电解质 | 高分子化合物 | |
A | NO2 | 纯碱 | 葡萄糖 |
B | 石英 | 氨水 | 淀粉 |
C | Mn2O7 | H2O | 锦纶 |
D | 醋酸酐 | HCl | 油脂 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长望浏宁四县高三一模考试化学试卷(解析版) 题型:实验题
【化学—选修2化学与技术】(15分)
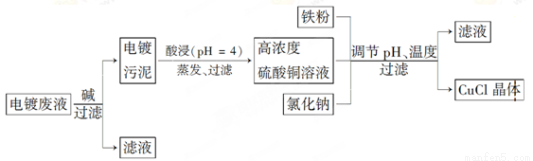
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。
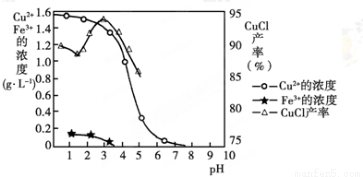
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.64g SO2含有氧原子数为NA
B.0.5mol/L MgCl2溶液,含有Cl-离子数为NA
C.标准状况下,22.4L H2O的分子数为NA
D.常温常压下,14g N2含有分子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com